题目列表(包括答案和解析)
在容器体积可变的密闭容器中,反应N
2(g)+3H
2(g)?2NH
3(g)在一定条件下达到平衡.
完成下列填空:
(1)若该反应经过2秒钟后达到平衡,NH
3的浓度增加了0.6mol/L,在此期间,正反应速率v(H
2)的值为______
A.0.6mol/ B.0.45mol/
C.0.3mol/ D.0.2mol/
(2)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v
正______(选填“增大”、“减小”,下同),v
逆______,平衡向______方向移动(选填“正反应”、“逆反应”).
(3)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为______反应(选填“吸热”、“放热”).
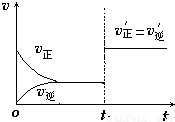
(4)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t
1时刻曲线发生变化的原因是______(填写编号).
a.增大N
2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH
3的百分含量______(选填“增大”、“减小”、“不变”).
(5)若达到平衡时,n(N
2):n(H
2):n(NH
3)=2:2:1.保持温度不变,以2:2:1的物质的量之比再充入N
2、H
2、NH
3,则______
A.平衡向正反应方向移动 B.平衡不移动
C.平衡时,NH
3的体积分数增大 D.平衡时,NH
3的体积分数可能减小.
查看答案和解析>>
在一容积为4L的密闭容器中,加入0.4mol的N
2和1.2mol的H
2,在一定条件下发生如下反应:N
2 (g)+3H
2 (g)═2NH
3 (g);△H<0,反应中NH
3的物质的量浓度变化情况如图1:
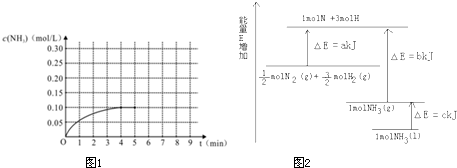
(1)根据上图,计算从反应开始到平衡时,平均反应速率v (NH
3)为
0.025
0.025
mol/(L?min).
(2)该反应的化学平衡常数表达式K
,随温度升高,K值将
减小
减小
(填“增大”、“减小”“不变”).
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH
3的物质的量浓度不可能为
ac
ac
.
a.0.20mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
(4)在一定条件下,合成氨反应已达化学平衡状态的是
C、D、E
C、D、E
(填序号).
A.3v(H
2)
(正)=2v(NH
3)
(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.条件一定,混合气体的平均相对分子质量不再变化
E.单位时间内1mol N≡N键断裂的同时,有3mol H-H键生成
F.单位时间内生成了n mol N
2的同时,减少了n mol NH
3(5)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
向正反应方向
向正反应方向
移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数
不变
不变
(填“增大”、“减小”或“不变”).
(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH
3的浓度约为0.25mol/L),请在图1中画出第5分钟末到此平衡时NH
3浓度的变化曲线.
(7)已知化学反应N
2+3H
2=2NH
3 的能量变化如图2所示,
①1mol N 和3mol H 生成1mol NH
3(g)是
释放
释放
能量的过程(填“吸收”或“释放”).
②
N
2(g)+
H
2(g)=NH
3(g);△H=
(a-b)kJ/mol
(a-b)kJ/mol
;
③N
2(g)和H
2生成NH
3(l)的热化学方程式为
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
.
查看答案和解析>>
在1L容积固定的密闭容器中进行A、B、C、D四种气体间的反应,容器内各物质的物质的量随时间的变化如下表:
| 时间/物质的量 |
n(A)(mol) |
n(B)(mol) |
n(C)(mol) |
n(D)(mol) |
| 起始 |
0.9 |
1.4 |
0 |
0.2 |
| 第1min |
0.6 |
1.1 |
0.15 |
|
| 第2min |
0.4 |
0.9 |
0.25 |
|
| 第3min |
0.3 |
0.8 |
|
0.8 |
| 第4min |
0.3 |
0.8 |
0.3 |
0.8 |
| 第5min |
0.35 |
0.85 |
0.275 |
0.75 |
根据以上信息回答下列问题:
(1)该反应的化学方程式为:
;
(2)反应到第2min时,用B表示的平均反应速率为
mol?L
-1?min
-1;
(3)反应到第3min时,A物质的转化率为
;
(4)实验表明升高温度该反应的平衡常数K值会减小,则该反应为
反应(填“放热”或“吸热”),在第4min时改变了某一条件,该条件可能是
;
A.升温 B.增加B的浓度 C.使用催化剂 D.通入稀有气体
(5)下列能说明该反应达到平衡状态的是
.
A.反应停止了 B.2v(B)
消耗=v(C)
消耗C.体系的密度保持不变 D.体系的压强保持不变.
查看答案和解析>>
BCl
3是重要的化工原料,其沸点12℃.500℃时,向2L的密闭容器中按一定比例投入B
2O
3、C、Cl
2,模拟工业制取三氯化硼.
(1)配平模拟工业制取三氯化硼的反应方程式:
B
2O
3(s)+
C(s)+
Cl
2(g)?
BCl
3(g)+
CO(g)
(2)若上述反应转移了0.3mol电子,则生成了
mol的BCl
3.
(3)反应至4min时达到平衡,则下列说法正确的是
.
A.3min时,CO的消耗速率大于氯气的消耗速率
B.2min至4min时BCl
3的生成速率比0至2min时的快
C.反应起始至平衡,气体的密度不断增大
D.达到平衡后,容器内的压强不再变化.
(4)达到平衡后,若向容器内加入少量的B
2O
3,则氯气的转化率将
(填:增大、减小、不变);若提高反应体系的温度,容器内的气体平均分子量减小,则该反应为
(填:“吸”、“放”)热反应.
(5)若要提高单位时间内BCl
3的产量,且保持平衡常数不变,下列做法正确的是
.
A. 增大反应容器的体积
B.将混合气体经冰水浴冷却后,再将气体升温至500℃循环进入反应容器
C.加入适当的催化剂
D.升高反应体系的温度.
(6)反应起始至3min时固体质量减少了15.84克,则氯气的平均反应速率为
.
查看答案和解析>>
T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是

A.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K增大
D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂
查看答案和解析>>
命题人:李孝平 审题人:李白仲
一、二选择题:(1―10题每题2分,11-18每题3分,共44分)
题 号
1
2
3
4
5
6
7
8
9
10
答 案
B
D
A
B
D
C
C
B
B
C
题 号
11
12
13
14
15
16
17
18
|
答 案 D B B C C D A A |
三、填空题:(本题共5小题,共46分)
19、①、③、⑧; ②、④; ⑤;
⑥、⑦;(每空1分)
20、(1) 略 3分 ;(2)略 4分
(3)c3>c1>c2;CH3COOH; D。(各2分)
21、(1)、4;(2分) (2)、大于(1分);因为升温水的电离平衡右移,离子浓度增大,Kw增大;(2分)
22、(1)H-O-O-H(2分) (2)N2H4(l)+H2O2(l)
== N2(g) +2H2O(l)
△H=-644.25
KJ/mol(3分)(3)产物不会造成环境污染。(1分)
23、(10分)(1)1 (2分) (2)否、(2分) 大于(1分) 因为
试卷.files/image027.gif)
试卷.files/image029.jpg)
试卷.files/image031.jpg)
= = <K平衡向右移动(3分)
(3)增大 减小(各1分)
24、(1)加快 (2)D (3)40% 试卷.files/image033.gif) L (各2分)
L (各2分)
25、(10分)⑴、反应产生气泡快慢或反应完成的先后或试管壁的冷热程度 ;
控制阴离子相同,排除阴离子的干扰 ; 将FeCl3改为Fe2(SO4)3
⑵、关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 一定时间内收集到的气体体积或收集一定体积的气体所需要的时间 ( 合理答案同样给分) 各2分




 2Z(g)
2Z(g)试卷.files/image027.gif)
试卷.files/image029.jpg)
试卷.files/image031.jpg)
试卷.files/image033.gif) L (各2分)
L (各2分)