
题目列表(包括答案和解析)
| ||
| ||
在CuSO4溶液里插入x、y两电极,在电解过程中,x极质量减少,y极增加,符合这一情况的是:![]()
A.x是石墨,y是铜棒 ![]()
B.x、y都是铜棒![]()
C.x、y都是石墨 ![]()
D.x是阴极,y是阳极![]()

A.x是石墨,y是铜棒 |
B.x、y都是铜棒 |
C.x、y都是石墨 |
D.x是阴极,y是阳极 |
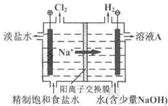 (2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
(2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
| ||
| ||
 HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出 HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出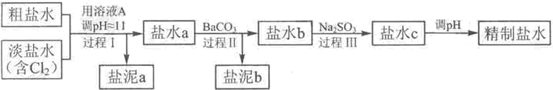
下列关于工业生产说法不正确的是( )
A.电解精炼铜时,用粗铜做阳极,纯铜做阴极,电解过程中,阳极质量增加与阴极质量减少不相等
B.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
C.在氯碱工粘中,电解槽中的阳离子交换膜只允许阳离子通过
D.在镀件上电镀锌,用锌作阳极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com