
题目列表(包括答案和解析)
将总物质的量为n mol的钠和铝(其中钠的物质的量分数为x),投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L。下列关系式中正确的是( )
A.x=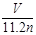 B.0 < x ≤ 0.5
B.0 < x ≤ 0.5
C.V=33.6n(1-x) D.11.2n < V ≤ 22.4n
将总物质的量为n mol的钠和铝(其中钠的物质的量分数为x),投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L。下列关系式中正确的是( )
A.x=![]() B.0 < x ≤ 0.5
B.0 < x ≤ 0.5
C.V=33.6n(1-x) D.11.2n < V ≤ 22.4n
将总物质的量为m mol的Na2O2和NaHCO3的混合物在密闭容器中加热至2.50℃,使其充分反应,NaHCO3在混合物中的物质的量分数为x。
(1)当x=l/2时,容器中固体产物 (写化学式),其物质的量为 。
(2)若反应后生成的气体为O2和H2O,则x的取值范围 。
(3)当0<x<l/3时,产生气体的物质的量n与x的数学表达式 (写化学式)。
将总物质的量为m mol的Na2O2和NaHCO3的混合物在密闭容器中加热至2.50℃,使其充分反应,NaHCO3在混合物中的物质的量分数为x。
(1)当x=l/2时,容器中固体产物 (写化学式),其物质的量为 。
(2)若反应后生成的气体为O2和H2O,则x的取值范围 。
(3)当0<x<l/3时,产生气体的物质的量n与x的数学表达式 (写化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com