水是生命之源,请据你学过的化学知识回答下列问题:
(1)从物质的组成角度看:水是由
氢、氧两种元素
氢、氧两种元素
组成的.
(2)从资源角度看:水是生命之源.涪江沿岸居民大多以涪江水为生活用水.为了弄清涪江水的水质状况,某化学兴趣小组对涪江水质进行了相关调查.
①取回水样,向浑浊的水中加明矾,其作用是
产生胶状物,吸附杂质,使杂质沉降
产生胶状物,吸附杂质,使杂质沉降
静置后过滤,得到澄清的水;过滤中使用的玻璃棒的作用是
引流
引流
.
②同学们用
肥皂水
肥皂水
可判断涪江水是硬水还是软水.
③生活中常用
煮沸
煮沸
的方法,即可降低水的硬度,又能消毒杀菌.
我国水资源总量居世界第六位.但从人均占有率看,不到世界人均占有量的四分之一,世界排名第 88 位,被列为世界人均水资源贫乏国家之一.而国人的节水意识却普遍比较淡薄,请你向大家介绍生活中的一条节水措施:
淘米水浇花等
淘米水浇花等
.
(3)从变化角度看:水通电分解生成最理想的能源──氢气,反应的文字表达式为
; 该反应属于
分解
分解
反应(填“分解或化合”). 同学们在完成电解水实验时,发现正极产生了10ml气体,则负极产生的气体体积是
20
20
ml.

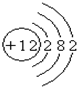 请根据物质构成的相关知识填空:
请根据物质构成的相关知识填空: