
题目列表(包括答案和解析)
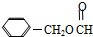 )是一种重要的工业使用的有机溶剂.分析如图的框图关系,然后回答问题:
)是一种重要的工业使用的有机溶剂.分析如图的框图关系,然后回答问题: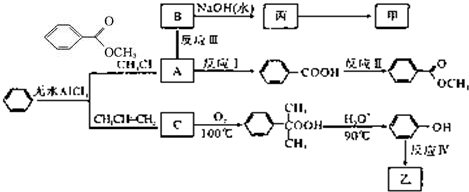
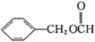
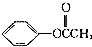
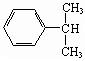

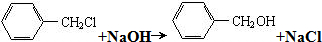
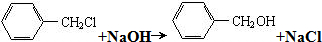
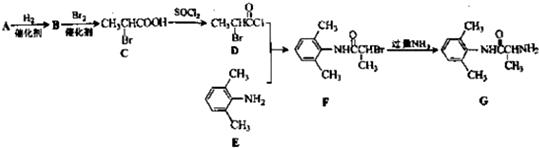
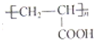 的单体,则A中含有的官能团是
的单体,则A中含有的官能团是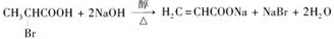
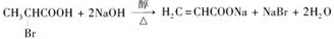
 、
、





(13分)安徽繁昌矿产资源十分丰富,其中峨山镇的随山主产辉铜矿。辉铜矿石主要含有硫化亚铜(Cu2S)、脉石(SiO2)和少量的银。孙村富铁矿业开发集团采用现代湿法炼铜工艺,用酸浸法从矿石中提取铜,其主要工艺流程图如下:

(1)矿泥的主要成分是______.
(2) 反应1中发生的离子方程式是______.
(3) 第一次萃取实验结束时,发现水层1的颜色仍然较蓝,接下来的操作是______
(4) 反萃取剂的作用是______。
(5) 反应2是用惰性电极电解水层2,写出阳极发生的反应方程式__________________
(6) 传统的湿法炼铜工艺是:粉碎矿石,先高温灼烧,加酸溶解产物,然后加人铁屑进一步得到铜。请评价两种工艺的优缺点________________________
(共13分)A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)____________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)__ __ > > 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为: 。
(3)在10 L的密闭容器中,通入2mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 kJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为 ;此时该反应的平衡常数K= 。
(4) 有人设想寻求合适的催化剂和电极材料,以C2、A2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式 ;
(共13分)A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)____________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)__ __ > > 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为: 。
(3)在10 L的密闭容器中,通入2mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 kJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为 ;此时该反应的平衡常数K= 。
(4) 有人设想寻求合适的催化剂和电极材料,以C2、A2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com