
题目列表(包括答案和解析)
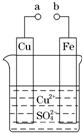 (2011?广东高考)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
(2011?广东高考)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )(10分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I ,II,III)作用下,CH4的产量随光照时间的变化如下图所示。

(1)
在O〜30小时内,CH4的平均生成速率 和
和 由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
(2) 将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应
CH4(g)+H2O(g) CO(g)
+3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
CO(g)
+3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
(3)
该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH⑴的燃烧热 分别为
分别为 和
和 ,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
(4)工业上常利用反应CO(g)+2H2(g)
 CH3OH (g), △H<0合成甲醇,在230°C〜270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
CH3OH (g), △H<0合成甲醇,在230°C〜270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
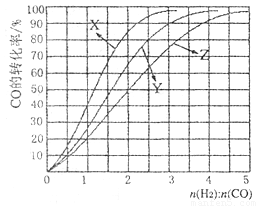
①2700C的实验结果所对应的曲线是_________ (填字母);
②2300C时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是_________ (填字母)。
A. 1 〜1.5 B. 2. 5〜3 C. 3. 5〜4. 5
(5) 某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为_________。
(10分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I ,II,III)作用下,CH4的产量随光照时间的变化如下图所示。
(1)在O〜30小时内,CH4的平均生成速率和
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
(2) 将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应
CH4(g)+H2O(g)CO(g)+3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
(3)该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH⑴的燃烧热分别为
和
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
(4)工业上常利用反应CO(g)+2H2(g) CH3OH (g), △H<0合成甲醇,在230°C〜270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
①2700C的实验结果所对应的曲线是_________(填字母);
②2300C时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是_________(填字母)。
A. 1 〜1.5 B. 2. 5〜3 C. 3. 5〜4. 5
(5)某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为_________。
(10分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I ,II,III)作用下,CH4的产量随光照时间的变化如下图所示。
(1) 在O?30小时内,CH4的平均生成速率 和
和 由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
(2) 将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应
CH4(g)+H2O(g) CO(g) +3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
CO(g) +3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
(3) 该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH⑴的燃烧热 分别为
分别为 和
和 ,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
(4)工业上常利用反应CO(g)+2H2(g)  CH3OH (g), △H<0合成甲醇,在230°C?270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
CH3OH (g), △H<0合成甲醇,在230°C?270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
①2700C的实验结果所对应的曲线是_________ (填字母);
②2300C时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是_________ (填字母)。
A. 1 ?1.5 B. 2. 5?3 C. 3. 5?4. 5
(5) 某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为_________。
 (2011?重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2011?重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
| x-2y |
| y |
| x-2y |
| y |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com