
题目列表(包括答案和解析)
(共14分)氟是一种氧化性极强的非金属元素,它甚至能与稀有气体氙反应生成XeF2、XeF4、XeF6等固体,这些固体都极易与水反应。其中XeF2与H2O仅发生氧化还原反应,而XeF4与H2O反应时,有一半的XeF4与H2O发生氧化还原反应,另一半则发生歧化反应:3Xe(Ⅳ)→Xe+2Xe(Ⅵ)。XeF6则发生非氧化还原反应完全水解。试回答下列问题:
(1) 写出XeF4与H2O反应的方程式 ;
(2) 14.72gXeF6完全水解后,再加入100mL 0.600mol?L-1 Mn2+的水溶液,反应完全后,放出的气体干燥后再通过红热的金属铜,体积减少20%。
① 通过计算可确定Mn2+的氧化产物为 ,相应的化学方程式为:
;
② 将所得溶液稀释到1000mL后,求溶液pH以及氟离子浓度。(已知弱酸HF在水溶液中存在电离平衡,Ka=![]() =3.5×10-4)溶液的pH为 ,F-浓度为 mol?L-1。
=3.5×10-4)溶液的pH为 ,F-浓度为 mol?L-1。
(3) 合成XeF2、XeF4、XeF6时通常用Ni制反应容器,使用前用F2使之钝化。
① 上述化合物的分子构型分别是 ;
② 使用Ni制反应容器前用F2钝化的两个主要原因是
;
③ 红外光谱和电子衍射表明XeF6的结构绕一个三重轴发生畸变。画出XeF6结构发生畸变的示意图:
(14分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的
Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为
Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式:
FeSO4+K2O2―→K2FeO4+K2O+K2SO4+O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是________________________________。
(14分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1) 上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Cu原子的核外电子排布式_____
(2) 根据等电子原理,写出CO分子的结构式_______________。
(3) 甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
① 甲醇的沸点比甲醛的高,其主要原因是______________________;甲醛分子中碳原子轨道的杂化类型为________。
② 甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
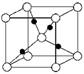
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为________。
(12分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高,实验测得,在常温常压下, 1 g H2完全燃烧生成液态水,放出
142.9 kJ热量,则H2燃烧的热化学方程式为__________________________________。
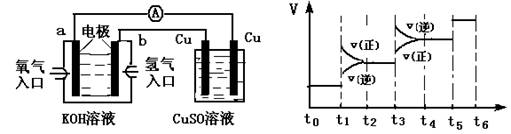
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现将氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,负极的电极反应式为__________________, ②如图实验装置中,某一铜电极的质量减轻3.2 g,则 a极上消耗的O2在标准状况下的体积____________L。
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)  2NH3(g);ΔH=-92.4 kJ/mol,
2NH3(g);ΔH=-92.4 kJ/mol,
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示: 图中t1时引起平衡移动的条件可能是_________________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50% ,则反应的平衡常数为____________。
(12分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高,实验测得,在常温常压下, 1 g H2完全燃烧生成液态水,放出
142.9 kJ热量,则H2燃烧的热化学方程式为__________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现将氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,负极的电极反应式为__________________, ②如图实验装置中,某一铜电极的质量减轻3.2 g,则 a极上消耗的O2在标准状况下的体积____________L。
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol,
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示: 图中t1时引起平衡移动的条件可能是_________________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50% ,则反应的平衡常数为____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com