
题目列表(包括答案和解析)
| ||
| △ |
| c2(SO3) |
| c(O2)c2(SO2) |
| c2(SO3) |
| c(O2)c2(SO2) |
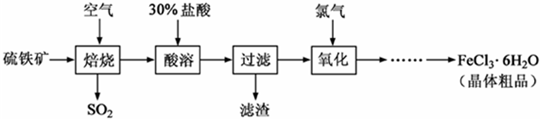
(18分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)将煅烧黄铁矿的化学方程式补充完整: +  Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 ;
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;
(4)该过程产生的污染空气的气体有三种,尾气均可用强碱溶液吸收,这些反应的离子方程式为 ;。
(5)从FeCl3溶液中得到FeCl3.6H2O晶体的操作为 。
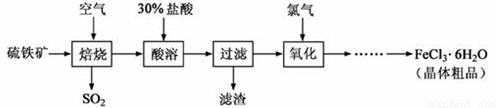
(16分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2 2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
(2)用36.5%(密度为1.2g·㎝-3)的盐酸的配制500mL的30%(密度为1.095g·㎝-3的盐酸,所需玻璃仪器是 ( )
| A.玻璃棒 | B.烧杯 | C.托盘天平 | D.500mL量筒 |
 溶液吸收,尾气中污染空气的气体为 (写化学式)。
溶液吸收,尾气中污染空气的气体为 (写化学式)。以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
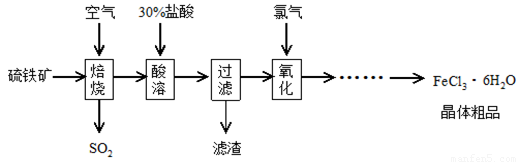
回答下列问题:
(1)焙烧硫铁矿的主要方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式) 。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在: 。
(5)如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为 。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K=
;
工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K=
;
工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
①V2O5作崔化剂 ②通入过量O2 ③SO2、O2进行二次氧化 ④通入过量SO2
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
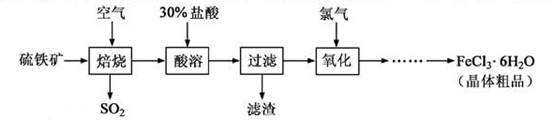
回答下列问题:
(1)在一定条件下,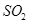 转化为
转化为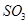 的反应为
的反应为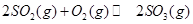 ,该反应的平衡常数表达式为K= ;过量的
,该反应的平衡常数表达式为K= ;过量的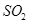 与
与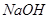 溶液反应的化学方程式为
溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的为其可用碱溶液吸收,为其中污染空气的气体为 (写化学)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com