
题目列表(包括答案和解析)
(15分) ![]() I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
![]()
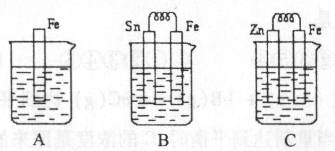
(1)A中反应的离子方程式为 ;
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”、“减小”或“不变”);
(3)C中被腐蚀的金属是 ,总反应式为 比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
II.现有常温下的6份溶液:①0.01 mol?L-1CH3COOH溶液;②0.01 mol?L-1HCl溶液;③pH=13的氨水;④pH=13的NaOH溶液;⑤0.01 mol? L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液;⑥0.01 mol?L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
(2)若将②、④混合后所得溶液pH=12,则消耗②、④溶液的体积之比为 ;
(3)将溶液同等稀释10倍后溶液的pH:③ ④,⑤ ⑥(选填“>”或“<”或“=”)。
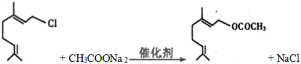
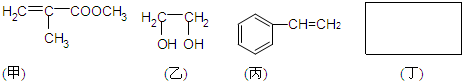
 )是重要的化工原料,广泛用于香料行业.
)是重要的化工原料,广泛用于香料行业.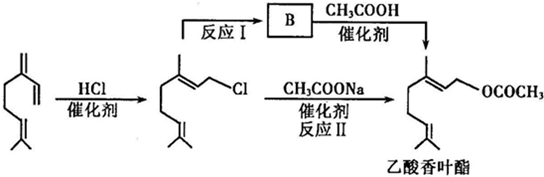


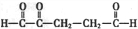
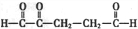
| 稀硫酸 |
| △ |
| 一定条件 |
| 浓硫酸 |
| 170℃ |
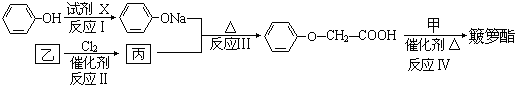
| 试剂X |
| NaOH溶液 |
| △ |
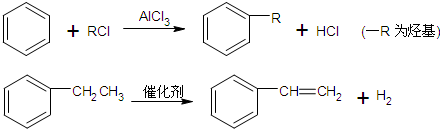
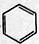 +CH3CH2Cl
+CH3CH2Cl| AlCl3 |
| △ |
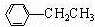 +HCl
+HCl +CH3CH2Cl
+CH3CH2Cl| AlCl3 |
| △ |
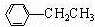 +HCl
+HCl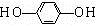
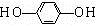
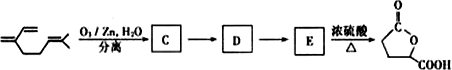
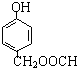
 -O-CH3-COOH)发生酯化反应的产物.
-O-CH3-COOH)发生酯化反应的产物.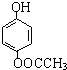
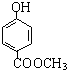

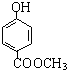

| ||
| Cl2 |
 -COOH,R-ONa
-COOH,R-ONa
| ||
| △ |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com