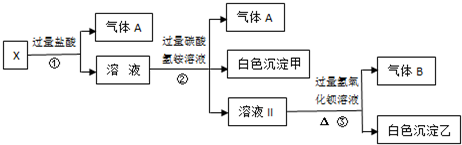
Fe是地壳中含量很丰富的元素,也是生物体所必须的元素.
(1)我国南方某些地区的井水取出久置之后,井水由澄清变成少量红棕色絮状沉淀积于缸底,水面浮着一层“锈皮”.这层“锈皮”的主要成分是(写化学式)
.
(2)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
(填字母代号);
A.4Fe(OH)
2+2H
2O+O
2═4Fe(OH)
3 B.2Fe+2H
2O+O
2═2Fe(OH)
2C.2H
2O+O
2+4e
-═4OH
- D.Fe-3e
-═Fe
3+(3)某化学研究性学习小组讨论Fe
3+和SO
32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe
3++SO
32-+H
2O═2Fe
2++SO
42-+2H
+;二是发生双水解反应:2Fe
3++3SO
32-+6H
2O═2Fe(OH)
3(胶体)+3H
2SO
3.为了证明是哪一种反应,同学们设计并实施了下列实验,请填写下列空白:
①实验Ⅰ,取5mLFeCl
3浓溶液于试管中,逐滴加入Na
2SO
3浓溶液,观察到溶液的颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na
2SO
3浓溶液至过量,溶液颜色加深,最终变为红褐色.这种红褐色液体是
.向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是
.将溶液分成两等份,其中一份加入KSCN溶液,溶液变为血红色,反应的离子方程式为
.另一份加入BaCl
2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式
.
②实验Ⅱ,换用稀释的FeCl
3和Na
2SO
3溶液重复实验Ⅰ,产生的现象完全相同.由上述实验得出的结论是
.
③若在FeCl
3浓溶液中加入Na
2CO
3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是
.
④从形式上看,Na
2CO
3和Na
2SO
3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
Ⅰ.
;
Ⅱ.
;
(4)自然界中铁矿石主要有赤铁矿和磁铁矿,应用高炉能冶炼制得金属铁.Fe
3O
4在高炉中有下列反应:Fe
3O
4+CO═3FeO+CO
2反应形成的固体混合物(FeO、Fe
3O
4)中,元素氧和铁的质量比用m(O):m(Fe)表示.设Fe
3O
4被CO还原的质量分数为x,则x与混合物中m(O):m(Fe)的关系式(用含m(O)、m(Fe)的代数式表示):x=
.