
题目列表(包括答案和解析)
 (1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
(1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:| 3 |
| 2 |
| 3 |
| 2 |
(08山东济宁模拟)8分)【化学―有机化学基础】
下图是以C7H8为原料合成某聚酰胺类物质(C7H5NO)n的流程图。

已知:(Ⅰ)当苯环上已经有了一个取代基时,新引进的取代基因受原取代基的影响而取代其邻、对位或间位的氢原子。使新取代基进入它的邻、对位的取代基有―CH3、―NH2等;使新取代基进入它的间位的取代基有―COOH、NO2等;
(Ⅱ)R―CH=CH―R′![]() R―CHO+R′―CHO
R―CHO+R′―CHO
(Ⅲ)氨基(―NH2)易被氧化;硝基(―NO2)可被Fe和盐酸还原成氨基(―NH2)
回答下列问题:
(1)X、Y各是下列选项中的某一项,其中x是 。(填写序号)
A.Fe和盐酸 B.酸性KMnO4溶液 C.NaOH溶液
(2)已知B和F互为同分异构体,写出物质F的结构简式 。
(3)分别写出D、E中的含氧官能团的名称 ; 。
(4)对物质C的下列说法中,正确的是 (填写序号)。
A.能发生酯化反应
B.能与溴水发生加成反应
C.只能和碱反应不能和酸反应
(5)写出反应⑦的化学方程式,并注明反应类型。
;
(08山东临沂质检)(8分) 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应 (发生的反应均为放热反应) 。生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间 (t) 的曲线如图所示。已知,生成C1O3-的反应为:6Ca (OH)2 + 6C12 = 5CaC12 + Ca (C1O3 ) 2 +6H2O。
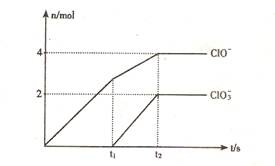
试回答:
(1)t2时,Ca(ClO)2与Ca (ClO3) 2的物质的量之和为 mol,该石灰乳中含有的Ca(OH)2的质量是 g。
(2)据分析,生成Ca (ClO3) 2的反应是由温度升高引起的,通人氯气的速度不同,n(ClO -)和n(ClO3-) 的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后:

| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.| 催化剂 | △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com