
题目列表(包括答案和解析)
(6分)盐酸是一种重要的化工原料,也是实验室中重要的化学试剂,初中化学中许多实验都用到了盐酸。
(1)打开浓盐酸的试剂瓶,观察到瓶口有 产生。下列实验中一定不会用到盐酸的是 (填序号)。
A.除去熟石灰中的石灰石 B.鉴别氯化钠和碳酸钠
C.实验室制取二氧化碳 D.除去铁钉上的锈迹
(2)用盐酸按照下图的方式进行中和反应实验,其化学反应方程式是 ,向烧杯中逐滴滴入盐酸至过量的过程中,能够说明盐酸与氢氧化钠发生了化学反应的实验现象是 。以下证明盐酸过量的操作及实验现象的叙述正确的是 (填序号)。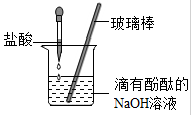
A.滴加石蕊溶液,搅拌后溶液变蓝
B.另滴加氢氧化钠溶液,搅拌后溶液颜色不变
C.加入蒸馏水,搅拌后溶液颜色不变
D.加入金属Cu片,产生气泡
| 实验过程与数据 | 分析与结论 |
| (1)取3g白色固体,加热 (2)冷却后称得固体的质量为2.9g |
白色固体中含有 结晶水 结晶水 |
| 实验步骤与现象 | 分析与结论 |
| (1)取少量样品,溶于水中 (2)滴入澄清的石灰水产生白色沉淀,继续滴加至不再产生白色沉淀为止,过滤 (3)在滤液中加入无色酚酞,溶液显红色 |
原白色固体中 一定含有NaOH和Na2CO3、NaOH和Na2CO3 |
| 实验步骤 | 实验现象 | 分析与结论 |
| (1)取少量样品,溶于水 (2)滴入CaCl2溶液 (3) 过滤 过滤 (4) 在滤液中加入无色酚酞 在滤液中加入无色酚酞 |
出现白色沉淀 出现白色沉淀 溶液不显红色 溶液不显红色 |
原白色固体中一定含有Na2CO3,一定不含NaOH |
氢氧化钠是一种重要的化工原料,也是实验室中常见的化学药品。
【观察】(1)实验室中盛放氢氧化钠溶液的试剂瓶是 (a、细口瓶;b、广口瓶),瓶塞是 (a、橡皮塞;b、玻璃塞)。
(2)盛放氢氧化钠溶液的试剂瓶的瓶口有白色固体。
【解释】形成白色固体的原因是: 。
【问题】白色固体中含有哪些物质?
【资料】(1)NaOH和 Na2CO3 受热不分解;
(2)NaOH的熔点为318.4℃,沸点为1390℃;Na2CO3的熔点为851℃。
【设计与实验】(请你帮助甲、丙实验小组完成实验报告)
实验小组甲:
| 实验过程与数据 | 分析与结论 |
| (1)取3g白色固体,加热 (2)冷却后称得固体的质量为2.9g | 白色固体中含有 |
实验小组乙:
| 实验步骤 与现象 | 分析与结论 |
| (1)取少量样品,溶于水中 (2)滴入澄清的石灰水产生白色沉淀,继续滴加至不再产生白色沉淀为止,过滤 (3)在滤液中加入无色酚酞,溶液显红色 | 原白色固体中 一定含有NaOH和 Na2CO3 |
实验小组丙:
| 实验步骤 | 实验现象 | 分析与结论 |
| (1)取少量样品,溶于水 (2)滴入CaCl2溶液 (3)
(4) |
| 原白色固体中一定含有 Na2CO3,一定不含NaOH |
【交流与评价】
三个实验小组代表汇报了各自的实验及其结论后,老师肯定了小组甲和小组丙的实验探究,同时指出了实验小组乙中存在的错误。这个错误是: 。
【拓展】老师提供了一个可证明原白色固体中成分的探究示例:
实验过程与数据:
步骤1:收集瓶口处白色固体,加热 ;
步骤2:取该白色固体样品3g;
步骤3:将固体溶于水后,滴入稀盐酸到不再产生气泡;
步骤4:测出收集到气体的质量为1.1g
二.计算分析与结论:
①计算分析:
②结论:原白色固体的成分为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com