
题目列表(包括答案和解析)
(14分)(白色固体X和Y共热得到A、B、C三种物质,C、D、E、H均为气体。其中C是一种能使湿润红色石蕊试纸变蓝的气体,D能使带火星的小木条复燃,H是一种红棕色、有刺激性气味的气体。Y受热易分解得到C和另外一种气体I,气体I的摩尔质量为36.5g/mo1。而X是制备漂白粉的原料之一.
(1)写出下列反应的化学方程式:
①X+Y ;
②A+Na2O2→D ;
③A+H→G+E .
(2)写出Y的电子式___________,并用化学方程式表示用X来制取漂白粉的原理 .
漂白粉在空气中露置易变质,请用化学方程式表示其变质过程:
; .
(14分)(白色固体X和Y共热得到A、B、C三种物质,C、D、E、H均为气体。其中C是一种能使湿润红色石蕊试纸变蓝的气体,D能使带火星的小木条复燃,H是一种红棕色、有刺激性气味的气体。Y受热易分解得到C和另外一种气体I,气体I的摩尔质量为36.5g/mo1。而X是制备漂白粉的原料之一.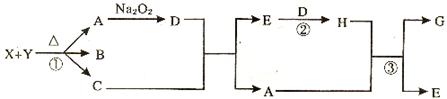
(1)写出下列反应的化学方程式:
①X+Y ;
②A+Na2O2→D ;
③A+H→G+E .
(2)写出Y的电子式___________,并用化学方程式表示用X来制取漂白粉的原理 .
漂白粉在空气中露置易变质,请用化学方程式表示其变质过程:
; .
(14分)(白色固体X和Y共热得到A、B、C三种物质,C、D、E、H均为气体。其中C是一种能使湿润红色石蕊试纸变蓝的气体,D能使带火星的小木条复燃,H是一种红棕色、有刺激性气味的气体。Y受热易分解得到C和另外一种气体I,气体I的摩尔质量为36.5g/mo1。而X是制备漂白粉的原料之一.

(1)写出下列反应的化学方程式:
①X+Y ;
②A+Na2O2→D ;
③A+H→G+E .
(2)写出Y的电子式___________,并用化学方程式表示用X来制取漂白粉的原理 .
漂白粉在空气中露置易变质,请用化学方程式表示其变质过程:
; .
 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
(共10分) W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素名称:W_________,X________,Y________,Z_________;Z在元素周期表中的位置_______ __。
(2)Y2Z的电子式为_______ __;W2X2的结构式__________。
(3)两种均含四种元素的化合物相互反应放出气体的化学方程式是 _______
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com