
题目列表(包括答案和解析)
(2010课标全国理综,8)分子式为C3H6Cl2的同分异构体共有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
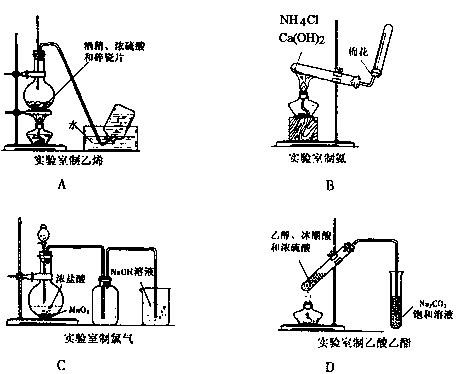
(2008年重庆卷,理综,8)下列实验装置图正确的是
(2008·全国理综) V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
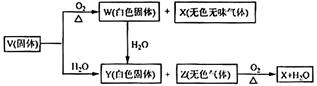
(1)5种化合物分别是V 、W 、X 、Y 、Z :(填化学式)
(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 :
(3)V的电子式是 。
(08年天津理综?26)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为__。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为__。
(3)X的硝酸盐水溶液显__性,用离子方程式解释原因__。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为__。
(5)比较Y、Z气态氢化物的稳 定性__>__(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
__>__>__>__。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式:________。
(2010课标全国理综,8)分子式为C3H6Cl2的同分异构体共有(不考虑立体异构)
| A.3种 | B.4种 | C.5种 | D.6种 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com