
题目列表(包括答案和解析)
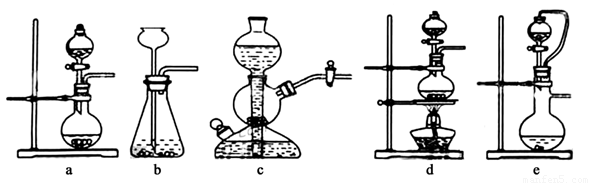
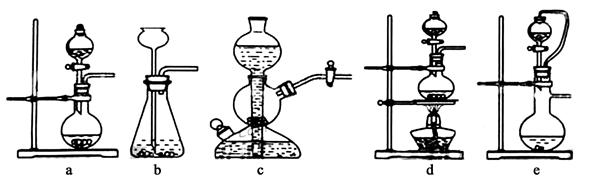
Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,下图中可选用的发生装置是 (填写字母)。
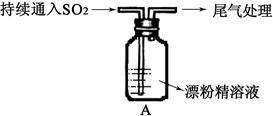
Ⅱ.A图表示某学生对SO2与漂粉精[80%Ca(ClO)2)]的反应进行实验探究的过程,观察到的现象有:
①.液面上方出现白雾;
②稍后,出现浑浊,溶液变为黄绿色;
③稍后,产生大量白色沉淀,黄绿色褪去
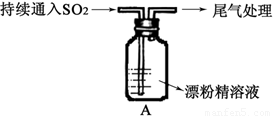
(1)向水中持续通入SO2,未观察到白雾。推测现象①中的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
由实验a、b不能判断白雾中含有HCl,理由是 。
(2)③中大量白色沉淀的成份是 。
(3)现象②中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应产生了Cl2。通过进一步实验确认了这种可能性,其实验方案是 。
(4)用离子方程式解释现象③中黄绿色褪去的原因: 。
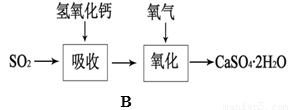
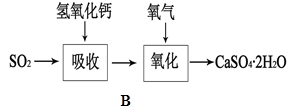
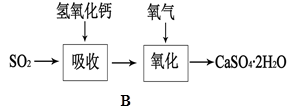
(5)B图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式。
。
Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,下图中可选用的发生装置是 (填写字母)。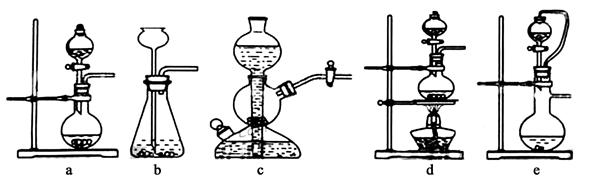
Ⅱ.A图表示某学生对SO2与漂粉精[80%Ca(ClO)2)]的反应进行实验探究的过程,观察到的现象有:
①.液面上方出现白雾;
②稍后,出现浑浊,溶液变为黄绿色;
③稍后,产生大量白色沉淀,黄绿色褪去
(1)向水中持续通入SO2,未观察到白雾。推测现象①中的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
由实验a、b不能判断白雾中含有HCl,理由是 。
(2)③中大量白色沉淀的成份是 。
(3)现象②中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应产生了Cl2。通过进一步实验确认了这种可能性,其实验方案是 。
(4)用离子方程式解释现象③中黄绿色褪去的原因: 。
(5)B图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式。
。

| 16a |
| 22.4b |
| 16a |
| 22.4b |
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com