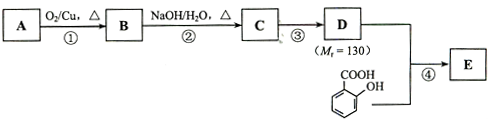
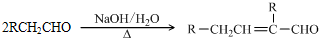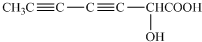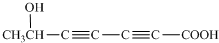(2013?天津)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM
2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM
2.5、SO
2、NO
x等进行研究具有重要意义.
请回答下列问题:
(1)将PM
2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol?L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM
2.5的酸碱性为
酸性
酸性
,试样的pH=
4
4
.
(2)为减少SO
2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H
2 (g)+
O
2 (g)=H
2O;△H=-241.81kJ?mol
-1C (s)+
O
2 (g)=CO (g);△H=-110.51kJ?mol
-1写出焦炭与水蒸气反应的热化学方程式:
C(s)+H2O(g)=CO(g)+H2(g);△H=+13l.3 kJ?mol-1
C(s)+H2O(g)=CO(g)+H2(g);△H=+13l.3 kJ?mol-1
.
②洗涤含SO
2的烟气.以下物质可作洗涤剂的是
a、b
a、b
.
a.Ca(OH)
2 b.Na
2CO
3 c.CaCl
2 d.NaHSO
3(3)汽车尾气中NO
x和CO的生成及转化
①已知汽缸中生成NO的反应为:N
2(g)+O
2(g)?2NO (g);△H>0
若1mol空气含0.8mol N
2和0.2mol O
2,1300℃时在密闭容器内反应达到平衡,测得NO为:8×10
-4 mol.计算该温度下的平衡常数:K=
4×10-6
4×10-6
.
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是
温度升高,反应速率加快,平衡右移
温度升高,反应速率加快,平衡右移
.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO (g)=2C (s)+O
2 (g)
已知该反应的△H>0,简述该设想能否实现的依据:
该反应是焓增、熵减的反应,任何温度下均不自发进行
该反应是焓增、熵减的反应,任何温度下均不自发进行
.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
.