
题目列表(包括答案和解析)
| A、Br2可用热空气吹出,其原因是Br2低温会化合 | B、Cl2氧化Br- 应在酸性条件下进行,目的是为了避免Br2歧化 | C、硫酸酸化生成NaBr、NaBrO3等的化学方程式是5NaBr+NaBrO3+3H2SO4→3Br2+3Na2SO4+3H2O | D、为了除去工业Br2中微量的Cl2,可向工业Br2中通入HBr |

| | 实验操作 | 实验现象 |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色。 |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:
|
|
实验操作 |
实验现象 |
|
I |
打开活塞a,滴加氯水,关闭活塞a |
A中溶液变为红棕色。 |
|
II |
吹入热空气 |
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
|
III |
停止吹入空气,打开活塞b,逐滴加入H2O2溶液 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
请回答下列问题:
(1)A中反应的离子方程式是 。
(2)实验操作II吹入热空气的目的是 。
(3)装置C的作用是 ,C中盛放的药品是 。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式 。
(5)由上述实验得出的结论是 。
(6)实验反思:
①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是 。
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可):
。
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。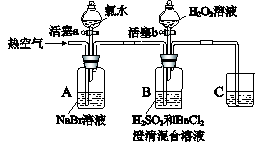
实验记录如下:
| | 实验操作 | 实验现象 |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色。 |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com