
题目列表(包括答案和解析)
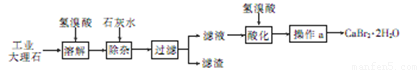
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:

完成下列填空:
35.上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500ml,所需的玻璃仪器有玻璃棒、 。
36.已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 、 。
37.试剂b是 ,步骤Ⅳ的目的是 。
38.步骤Ⅴ所含的操作依次是 、 。
39.制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ ;⑤称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
若实验操作规范而测定结果偏低,其原因是 。
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 难溶 | 难溶 | 难溶 |
 +Br2
+Br2| 溴化铁 |
 +HBr
+HBr +Br2
+Br2| 溴化铁 |
 +HBr
+HBr溴化钙(CaBr2·2H2O)是一种白色晶体,易溶于水,有很强的吸湿性,是光敏纸矿泉水和灭火剂的重要成分,在医药上用作治疗神经衰弱等的药物,也用作化学分析。用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下
回答下列问题
(1)溶解时发生的主要反应的离子方程式为
(2)除杂步骤控制溶液的pH约为8.0的目的是 ,
(3)滤液用氢溴酸酸化的目的是 ,操作a主要包括 , 和过滤
(4)制得的溴化钙晶体可以通过如下步骤测定其纯度:
①称取5.00g溴化钙晶体样品,②溶解;③滴入足量Naa2CO3溶液,充分反应后过滤,④烘干、冷却;⑤称量。若得到2. 00 g碳酸钙,则样品的纯度为
(5)溴化钙晶体中溴离子和钙离子的检验
①将少量溴化钙晶体溶于水,加入硝酸酸化的AgNO3溶液,实验现象为 ,发生反应的离子方程式为
②将少量溴化钙晶体溶于水,滴加草酸钠溶液,实验现象为 ,发生反应的离子方程式为
A.乙烯的结构式C2H4
B.乙醇的结构式C2H6O
C.硫原子的结构示意图![]()
D.溴化钙的电子式![]()
水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示:

(注:粒子浓度很小时常用负对数表示,如pH=-lgc(OH-),pCl=-lgc(Cl-)):
(1)正常海水(Cl-的浓度大于0.1mol/L)中汞元素的主要存在形态是
。少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是
。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 (用离子方程式表示),为了防止出现浑浊,可采取的措施是
。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含Hg2+的废水。反应的离子方程式为
。
②化学沉淀法:用硫化钠处理含HgCl2的废水,生成HgS沉淀。反应的离子方程式为
。
(4)汞虽然有毒,但用途广泛。用汞和溴化钙作催化剂,可以在较低温度下经过下列反应使水分解制氢气和氧气:
①CaBr2+2H2O=Ca(OH)2+2HBr↑
②……
③HgBr2+Ca(OH)2=CaBr2+HgO+H2O
④2HgO=2Hg+O2↑
反应②的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com