
题目列表(包括答案和解析)
部分弱酸的电离平衡常数如下表:
|
弱酸 |
HCOOH |
HClO |
H2CO3 |
H2SO3 |
|
电离平衡常数 (25℃) |
|
|
|
|
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A.2ClO- + H2O + CO2 → 2HClO + CO32-
B.2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C.H2SO3 + 2HCOO- → 2HCOOH + SO32-
D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( )
A.H2O2既是氧化剂又是还原剂
B.H2O 既不是氧化产物又不是还原产物
C.H2SeO4既是氧化产物又是还原产物
D.氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸, ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
HI+ H6TeO6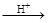 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
(6)若反应中生成的TeO2与Te的物质的量之比为 ,试配平上述化学方程式。
,试配平上述化学方程式。
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、2CN-+H2O+CO2→2HCN+CO32- |
| B、2HCOOH+CO32-→2HCOO-+H2O+CO2↑ |
| C、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
| D、等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |
(2011?奉贤区二模)25时,部分弱酸的电离平衡常数如下表:
|
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是(?? )
①2CN-+H2O+CO2=2HCN+CO32-
②2HCOOH+CO32-=2HCOO-+H2O+CO2↑
③中和等体积、等pH的HCOOH和HCN,消耗NaOH的量前者小于后者
④等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
A.①②?????? B.②③?????? C.③④?????? D.①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com