
题目列表(包括答案和解析)
在隔膜法电解食盐水过程中,与电源正极相联的电极上所发生反应为________________________,与电源负极相连的电极附近溶液的pH________(填“升高”、“下降”或“不变”).离子交换膜的作用是______________________,若采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为___________________.
在隔膜法电解食盐水过程中,与电源正极相联的电极上所发生反应为________,与电源负极相连的电极附近溶液的Ph________(填“升高”、“下降”或“不变”).离子交换膜的作用是________,若采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为________.
在隔膜法电解食盐水过程中,与电源正极相联的电极上所发生反应为________,与电源负极相连的电极附近溶液的pH________(填“升高”、“下降”或“不变”).离子交换膜的作用是________,若采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为________.
氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:
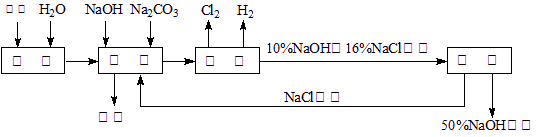
依据上图,完成下列填空:
(1)在电解过程中化学反应方程式为 ,与电源负极相连的电极附近收集到的气体是 。
(2)如果粗盐中SO42—含量较高,必须添加钡试剂除去SO42—,该钡试剂可以是 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2 D.BaSO4
(3)如何除去粗盐中含有的CaCl2、MgCl2及Na2SO4(实际上是指Ca2+、Mg2+及 SO42-),具体操作有: A、过滤 B、加足量的BaCl2溶液 C、加适量的稀盐酸
D、加足量的NaOH溶液 E、加足量的Na2CO3溶液
具体操作的顺序为
(4)脱盐工序中,通过加热浓缩、冷却、过滤的方法除去NaCl,该方法利用的是NaOH与NaCl这两物质在 上的性质差异。
(5)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应;若采用无隔膜电解冷的食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:
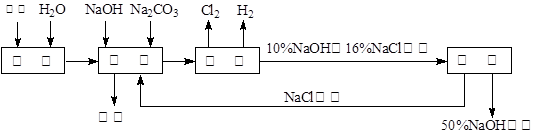
依据上图,完成下列填空:
(1)在电解过程中化学反应方程式为 ,与电源负极相连的电极附近收集到的气体是 。
(2)如果粗盐中SO42—含量较高,必须添加钡试剂除去SO42—,该钡试剂可以是 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2 D.BaSO4
(3)如何除去粗盐中含有的CaCl2、MgCl2及Na2SO4(实际上是指Ca2+、Mg2+及 SO42-),具体操作有: A、过滤 B、加足量的BaCl2溶液 C、加适量的稀盐酸
D、加足量的NaOH溶液 E、加足量的Na2CO3溶液
具体操作的顺序为
(4)脱盐工序中,通过加热浓缩、冷却、过滤的方法除去NaCl,该方法利用的是NaOH与NaCl这两物质在 上的性质差异。
(5)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应;若采用无隔膜电解冷的食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
一、选择题(3×16=48分)
1.C 2.D 3.C 4.B 5.C 6.D 7.A 8.A 9.A 10.D 11.C 12.B 13.C 14.A 15.D 16.D
二、(5+7+6=18分)
17.(6分)
(1)结构 性质 用途 制法(2分);结构特点(1分)
(2)BD(3分,选1个得1分,错选得0分)
18.(第二空1分,其余每空2分,共7分)
2Clˉ-2e- = Cl2↑ 升高
阻止气体分子和某些离子通过,防止氢气和氯气混合发生爆炸,并能避免氯气和氢氧
化钠溶液作用生成次氯酸钠而影响烧碱的质量
NaCl +H2O  NaClO + H2 ↑
NaClO + H2 ↑
或 2 NaCl + 2 H2O
 H2↑ +
Cl2↑+
2NaOH
H2↑ +
Cl2↑+
2NaOH
Cl2 + 2NaOH ==== NaCl + NaClO + H2O
19.(6分)
(1)接触室(1分);热交换器(1分);使反应生成的热传递给进入接触室需预热的炉气,同时冷却生成的气体(1分)
(2)
(3)小于 (1分)
三、(12+10=22分)
20.(12分)
(1)Na+[∶H]-(2分)
??(2)阳极:4OH--4e-=O2↑+2H2O(2分)
???? 阴极:4Na++4e-=4Na(2分)
??(3)NaH+HCl=NaCl+H2↑(2分)
??(4)H2、Cl2、NaOH、HCl (4分)
21. (10分)
(1)N2H4(1)+O2(g)=N2(g)+2H2O;△H=-624kJ/mol(2分)
(2)①Cu2++2e-=Cu(2分) ②112 (2分)
(3)ClO-+2NH3=N2H4+Cl-+H2O(2分)
(4)N2+6H++6e-==2NH3 (2分)
四、(14分)
22.(14分)
方案Ⅰ:偏低(1分)
方案Ⅱ:①托盘天平(砝码)、药匙、酸式和碱式滴定管、锥形瓶(2分)
②B (1分)
③  (1分)
(1分)
方案Ⅲ:①保证CaCO3完全分解 (1分)
②应在干燥中冷却(1分)
方案Ⅳ:①A、B (2分)
②C (1分)
③偏高(1分)
方案Ⅱ(1分)
方案Ⅰ:气体体积难以准确测量(1分)
方案Ⅲ:实验室难以提供
五、计算(8分)
23. 1.13t(写出有关化学方程式或关系式4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com