
题目列表(包括答案和解析)
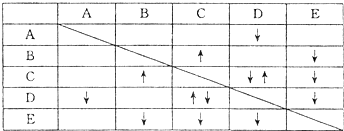
(8分)实验室有 NaHSO4 ,Ba(OH)2, NH3 ? H2O NaHCO3、KAl(SO4)2五种无色溶液,现欲通过它们之间的相互反应现象对其进行鉴别。部分物质间的反应现象如下表: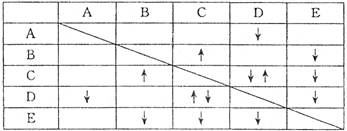
表中“ ”表示生成气体物质,“
”表示生成气体物质,“ ”表示生成沉淀。
”表示生成沉淀。
根据以上信息,回答以下问题:
(1)B、E的化学式分别为_______、___________;
(2) 写出A的电离方程式___________________________:;
(3) C、D两溶液反应的离子方程式为___________________________;
(4) 向含有0.1 mol溶质的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为_________mol。
(8 分)实验室有 NaHSO4 ,Ba(OH)2, NH3 • H2O NaHCO3、KAl(SO4)2 五种无色溶液,现欲通过它们之间的相互反应现象对其进行鉴别。部分物质间的反应现象如下表:
表中“ ”表示生成气体物质,“
”表示生成气体物质,“ ”表示生成沉淀。
”表示生成沉淀。
根据以上信息,回答以下问题:
(1)B、E的化学式分别为_______、___________;
(2) 写出A的电离方程式___________________________:;
(3) C、D两溶液反应的离子方程式为___________________________;
(4) 向含有0.1 mol溶质的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为_________mol。
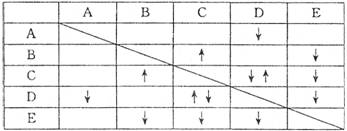
(8分)实验室有NaHSO4 ,Ba(OH)2, NH3 • H2O NaHCO3、KAl(SO4)2五种无色溶液,现欲通过它们之间的相互反应现象对其进行鉴别。部分物质间的反应现象如下表:
表中“”表示生成气体物质,“
”表示生成沉淀。
根据以上信息,回答以下问题:
(1)B、E的化学式分别为_______、___________;
(2)写出A的电离方程式___________________________:;
(3)C、D两溶液反应的离子方程式为___________________________;
(4)向含有0.1 mol溶质的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为_________mol。
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com