
题目列表(包括答案和解析)
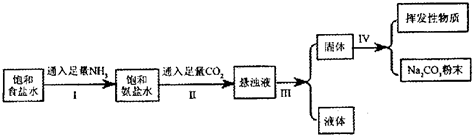
| 物质 | NH4Cl | NaHCO3 | Na2CO3 | NaCl |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
下列溶液中有关微粒的物质的量浓度关系正确的是 ( )
A.pH=4的0.1 mol·L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-)
B.NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):
c(Na+)=c(HRO3—)+2c(RO32—)
C.常温下,等物质的量浓度的三种溶液:①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2中c(NH4+):①<③<②
D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:
c(Na+)>c(Cl—)=c(CH3COOH)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com