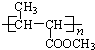(2013?江西模拟)化合物A是尿路结石的主要成分,属于结晶水合物,可用X?H
2O表示.在一定条件下有如图(1)所示的转化关系:

已知:
①经分析,图(1)中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1:1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同.
②G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因.
③反应②、③是重要的化工反应,I是一种重要的化工原料.
④图(1)中的部分变化经定量测定,得到如图(2)所示的固体产物的质量分数[ω(%)]随温度[T(℃)]的变化曲线.

回答下列问题:
(1)写出A的化学式:
CaC2O4?H2O
CaC2O4?H2O
,D中阴离子的结构示意图为
;
(2)反应①的化学方程式为:
.
(3)写出电解反应②的化学方程式,并标出电子转移的方向和数目:
.
(4)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染.
①若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明.则O的分子式为:
CH4O
CH4O
.
②若O是K与G按1:3的比例反应而得,则O可能是
B
B
.(填编号)
A.烷烃B.烯烃C.炔烃D.芳香烃.

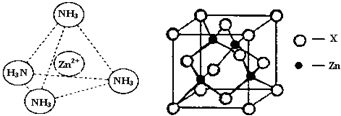






 (2012?成都模拟)一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4?H2O]是一种重要的染料及农药中间体.请回答下列相关问题:
(2012?成都模拟)一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4?H2O]是一种重要的染料及农药中间体.请回答下列相关问题: