
题目列表(包括答案和解析)
|
下列热化学方程式中,ΔH能表示对应物质的标准燃烧热的是 | |
| [ ] | |
A. |
CO(g)+ |
B. |
C(s)+ |
C. |
H2(g)+ |
D. |
2C8H18O(l)+25O2(g) |
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要反应为:
C+H2O
已知:
1 mol H2O(g)转化为1 mol H2O(l)放出44.0 kJ的热量.回答下列问题:(1)写出C不完全燃烧的热化学方程式:________.
(2)现有H2或CO为燃料提供热能,你认为应该选择________(填写序号);
a.H2 b.CO c.均可以理由是________.
(3)甲同学根据1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量总和比1 mol C(s)完全燃烧放出的热量多,认为:“煤燃烧时加少量水,可以使煤燃烧放出更多的热量.”乙同学根据盖斯定律写出下列循环图:
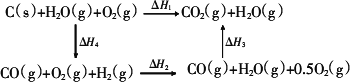
据此,乙同学认为:“将煤转化为水煤气再燃烧放出的热量与直接燃烧煤放出的热量一样多,而将煤转化为水煤气会增加生产环节、增加消耗,因此,将煤转化为水煤气得不偿失.”请你对甲、乙两同学的观点的正确性进行评价并阐述你的理由:
________. FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。 FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(20分)己知:
(1)2C(石墨s)+O2 (g) = 2CO(g) △H=-222KJ/mol
(2)2 H2(g)+O2(g)=2 H2O(g) △H=-484KJ/mol
(3)C(石墨s)+O2(g)=CO2(g) △H=-393.5KJ/mol
(4)H2O(g)=H2O(L) △H=-44KJ/mol
(5)C(金刚石s)+O2(g)=CO2(g) △H=-395.4KJ/mol
回答下列问题:
(1)C(石墨)的燃烧热为 。
(2)写出表示H2的燃烧热的热化学方程式: 。
(3)写出石墨转化为金刚石的热化学方程式(可不注明条件) 。相对更稳定的物质是 。
(4)工业上制H2的一个重要反应是:CO(g)+H2O(g)?CO2 (g)+H2(g)
①该反应的△H= 。
②为了提高CO的转化率,下列措施可采用的是 。
A、升高温度 B、增大压强
C、选择合适的催化剂 D、增大H2O(g)的浓度
③平衡常数K的表达式:K= 。
④800℃时,该反应的平衡常数K=1,则850℃时K 1(填.>、<、=)
⑤800℃时,若起始浓度:C(CO)=1 mol/L, C(H2O)=4mol/L,则达平衡时,C(H2)= ,CO的转化率为 。
把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)![]() CO2(g) ΔH1<0①
CO2(g) ΔH1<0①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH2>0②
CO(g)+H2(g) ΔH2>0②
再燃烧水煤气:2CO(g)+O2(g)![]() 2CO2(g) ΔH3<0③
2CO2(g) ΔH3<0③
2H2(g)+O2(g)![]() 2H2O(g) ΔH4<0④
2H2O(g) ΔH4<0④
请回答下列问题:
(1)途径Ⅰ放出的热量________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量,原因是________.
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是________.
(3)12 g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35 kJ热量.其热化学方程式为(相对原子质量C-12)________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com