
题目列表(包括答案和解析)
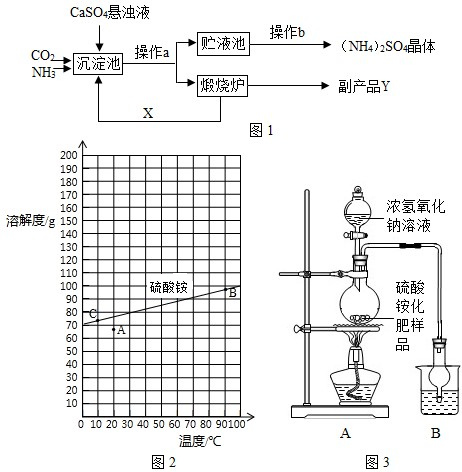
| ||
| ||
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |
| 指标 项目 |
优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶, 无可见机械杂质 |
无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
分析:H2SO4和BaCl2反应生成BaSO4和HCl,再用NaOH中和剩余H2SO4时,不能忽视NaOH又和生成HCl发生反应的这个隐蔽反应,而且这个反应是解题时不走弯路的关键。
【常规解法】(l)设BaCl2消耗H2SO4的质量为x,反应生成HCl的质量为y
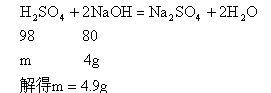 (2)设HCl消耗NaOH的质量为z
(2)设HCl消耗NaOH的质量为z
在反应中共消耗NaOH质量为32g×25%=8g,中和HCl用去4g,尚余4g
 (3)设4gNaOH中和的H2SO4质量为m
(3)设4gNaOH中和的H2SO4质量为m
硫酸中溶质的质量分数为
 答案:(略)
答案:(略)
【解法二】此题稍加分析,即可一步解出:用BaCl2的量不能求出H2SO4的量是因BaCl2不足量,而用NaOH的量却可求出H2SO4的量,因二者是完全中和的反应。之所以可用NaOH 而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
设:H2SO4的量为x

硫酸中溶质的质量分数为 答案:(略)
答案:(略)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com