28、请你参与某学习小组进行研究性学习的过程,并协助完成相关任务:
【研究课题】探究热水壶底部水垢的主要成分
【查阅资料】该小组同学通过查阅资料知道,天然水中一般都含有Ca
2+、Mg
2+、HCO
3-等离子,在加热时,这些离子趋于生成溶解度更小的物质-水垢(主要成分为碳酸盐、碱等的混合物),水垢中一定含有Mg(OH)
2和CaCO
3.同时,他们还查阅到下列有关物质的溶解性:
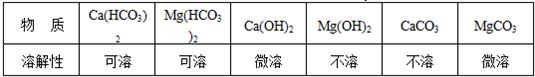
【提出猜想】水垢的主要成分除一定含有Mg(OH)
2和CaCO
3之外,还可能含有Ca(OH)
2和
MgCO3
.
【设计方案】
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入
Na2CO3溶液
,没有白色沉淀,说明水垢中无Ca(OH)
2;
(2)乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐的成分,步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
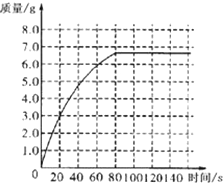
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变.
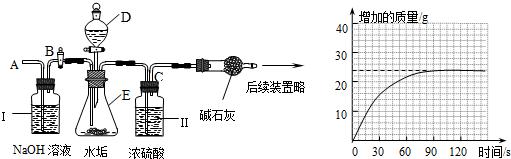
a.仪器D、E的名称分别是
分液漏斗
、
锥形瓶
;若要检查盛放浓硫酸的洗气瓶双孔塞上导气管与橡皮塞接触的地方(即上图装置中C处)是否漏气,应在装药品之
前
(填“前”或“后”)检查,请写出检查C处是否漏气的方法:
在C处导气管周围滴少量水,关闭B活塞和分液漏斗的活塞,将干燥管左边橡皮管用弹簧夹夹紧,用热毛巾捂锥形瓶,若C处有气泡冒出,说明C处漏气,若C处没有气泡冒出,说明C处不漏气
.
b.步骤①所加的酸溶液是
稀盐酸
;请写出水垢中难溶性物质与酸反应的化学方程式:
Mg(OH)2+2HCl═MgCl2+2H2O
、
CaCO3+2HCl═CaCl2+CO2↑+2H2O
;
c.装置Ⅱ的作用是
吸收CO2中的水
;从导管A处缓缓鼓入一定量的空气时,装置Ⅰ的作用是
除去空气中的CO2
.
d.研究性小组的同学通过简单计算,认为水垢中一定含有MgCO
3,理由是
如果50g水垢全部为CaCO3,产生CO2的质量应为22g,而实验测得生成的CO2质量为24g,大于了22g,故一定含有50g固体与足量的稀盐酸反应生成的CO2质量大于22g的MgCO3
.
【实验结论】通过上述探究可知:水垢的主要成分有
Mg(OH)2、CaCO3、MgCO3
.

 某化学兴趣小组为测定大理石中碳酸钙的含量,将过量的稀盐酸加入到20g大理石中(其它成分不与盐酸反应),把产生的CO2气体用足量的NaOH溶液吸收,同时测量2分钟内NaOH溶液增加的质量,结果如下表所示:
某化学兴趣小组为测定大理石中碳酸钙的含量,将过量的稀盐酸加入到20g大理石中(其它成分不与盐酸反应),把产生的CO2气体用足量的NaOH溶液吸收,同时测量2分钟内NaOH溶液增加的质量,结果如下表所示:
 某化学兴趣小组为测定大理石中碳酸钙的含量,将过量的稀盐酸加入到20g大理石中(其它成分不与盐酸反应),把产生的CO2气体用足量的NaOH溶液吸收,同时测量2分钟内NaOH溶液增加的质量,结果如表所示:
某化学兴趣小组为测定大理石中碳酸钙的含量,将过量的稀盐酸加入到20g大理石中(其它成分不与盐酸反应),把产生的CO2气体用足量的NaOH溶液吸收,同时测量2分钟内NaOH溶液增加的质量,结果如表所示:
