
题目列表(包括答案和解析)
(7分)为综合利用生产过程中的副产品CaSO4,某化工厂设计了以下制备(NH4)2SO4的工艺流程: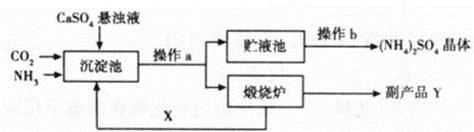
(1)此流程中,在沉淀池发生的化学反应为CO2+2NH3+CaSO4+H2O==CaCO3↓+ (NH4)2SO4
在煅烧炉中发生的化学反应方程式为 ;该工艺中可循环使用的X为 (填化学式);副产品Y有何用途 (填一种即可)。
(2)从贮液池中获得(NH4)2SO4晶体要进行操作b,操作b是 。若经过一定处理后的贮液池中,形成30℃时(NH4)2SO4的饱和溶液,则此时溶质质量分数为 (已知30℃时硫酸铵的溶解度为78g)。
(3)欲制备6.6t (NH4)2SO4晶体,理论上需要CaSO4多少吨?
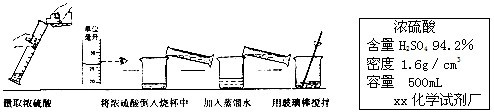
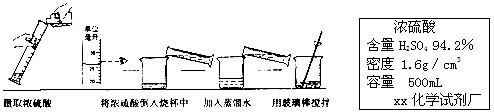

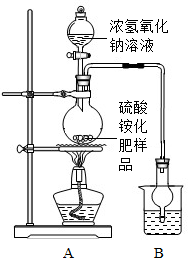 某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.
某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.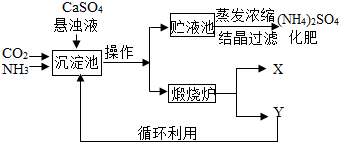
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com