
题目列表(包括答案和解析)
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
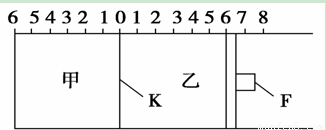
(1)若固定隔板K,能表示甲容器中一定达到化学平衡的是
A.甲中气体的总压强不变 B.各气体的物质的量浓度不变
C.混合气体的平均摩尔质量不变 D.混合气体的密度不变
E.反应速率v(SO2)=v(SO3)
(2)达到平衡后隔板K是否可能处于0刻度 ________(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(3)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为________mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度______处(填下列序号:①<6 ②>6 ③=6)。
(4)若一开始就将K、F固定,其他条件均不变,甲平衡后压强变为开始压强的0.8倍,则甲、乙都达到平衡后,两容器的压强之比为P甲:P乙=
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g) CO2(g) ΔH=b kJ·mol-1;反应③Fe2O3(s)+3CO(g)
CO2(g) ΔH=b kJ·mol-1;反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=c kJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH=c kJ·mol-1。测得在不同温度下,K值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(2)反应①为 (选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积B.通入CO2C.温度升高到900 ℃D.使用合适的催化剂
E.增加Fe的量
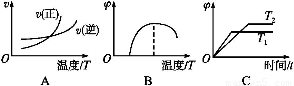
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
已知2SO2(g)+O2(g)  2SO3(g) ΔH=-a kJ·mol-1(a>0)。恒温恒容下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0.025 a kJ。下列判断正确的是( )
2SO3(g) ΔH=-a kJ·mol-1(a>0)。恒温恒容下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0.025 a kJ。下列判断正确的是( )
A.在2 min内,v(SO2)=0.25 mol·L-1·min-1
B.若再充入0.1 mol SO3,达到平衡后SO3的质量分数会减小
C.在1 min时,c(SO2)+c(SO3)=0.01 mol·L-1
D.若恒温恒压下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,平衡后反应放热小于0.025a kJ
(15分)(一)一定温度下,在体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:2X(g) +
Y(g)  a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值将 (填“增大”.“减小”或“不变”)。
(2)化学计量数a的值为 ,该反应的熵变△S 0(填“>”.“<”或“=”)。
(3)平衡后,若压缩容器体积,则再达到平衡后X的浓度将________(填“增大”、“减少”或“不变”) X的转化率α= (用含Q.Q1的代数式表示)。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX.1mol Y.1molAr B.a molZ.1mol W
C.1 molX.0.5mol Y.0.5a molZ.0.5 mol W D.4 molX.2mol Y
(二)若在相同温度下,将2 mol X和1 mol Y加入到容积固定不变的甲容器中,将2amol Z和2 mol W加入到容积可变的乙容器中,t1=5 min时两容器内均达到平衡状态,甲中c(Z)=1.5 mol/L。

请回答下列问题:
(1)5 min内,用X物质表示甲容器中的平均反应速率v(X)=________。
(2)保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙容器中Z的物质的量浓度c(Z)________(填“>”“<”或“=”)3 mol/L。
(3)保持温度不变,t2时分别向甲、乙中加入等质量的氦气后,下图中能表示甲中反应速率变化情况的是________,能表示乙中反应速率变化情况的是________。

(15分)(一)一定温度下,在体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:2X(g) + Y(g) 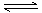 a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值将 (填“增大”.“减小”或“不变”)。
(2)化学计量数a的值为 ,该反应的熵变△S 0(填“>”.“<”或“=”)。
(3)平衡后,若压缩容器体积,则再达到平衡后X的浓度将________(填“增大”、“减少”或“不变”) X的转化率α= (用含Q.Q1的代数式表示)。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
| A.2 molX.1mol Y.1molAr | B.a molZ.1mol W |
| C.1 molX.0.5mol Y.0.5a molZ.0.5 mol W | D.4 molX.2mol Y |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com