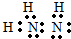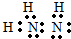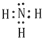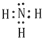(2013?浦东新区二模)化学的魅力之一来自于许许多多的“最”.例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇….根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式
,该分子属于
极性
极性
(填“极性”或“非极性”)分子.
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
Na>Cl
Na>Cl
(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是
共价
共价
键.
(3)就物理性质而言,第二周期原子序数最小的元素的单质是
密度
密度
最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式:
Be(OH)2+2NaOH→Na2BeO2+2H2O
Be(OH)2+2NaOH→Na2BeO2+2H2O
.
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是
a
a
.
d
d
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等.

 (2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.
(2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.