CuSO
4溶液与Na
2CO
3溶液混合产生蓝绿色沉淀,以下是某兴趣小组对沉淀组成的探究.
提出假设:
假设1:沉淀为Cu (OH)
2假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO
3?mCu (OH)
2]
查阅资料:
无论是哪一种沉淀受热均易分解(假设均不含结晶水).
定性探究:
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;
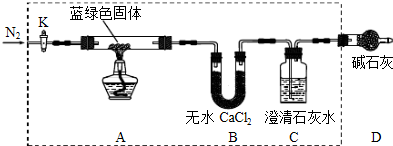
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设
成立.
(2)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是
(填代号).
a.浓硫酸 b.无水CuSO
4 c.碱石灰 d.P
2O
5(3)乙同学更换B试剂后验证假设3成立的实验现象是
.
定量探究
(4)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)
2溶液,其原因是
(双选,填代号)
| 溶解度(S)/g |
溶度积(Ksp) |
摩尔质量(M)/g?mol-1 |
| Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
CaCO3 |
BaCO3 |
| 0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
100 |
197 |
a.Ba(OH)
2溶解度大于Ca(OH)
2,能充分吸收CO
2b.Ba(OH)
2为强碱,Ca(OH)
2为弱碱
c.吸收等量CO
2生成的BaCO
3的质量大于CaCO
3,测量误差小
d.相同条件下,CaCO
3的溶解度明显大于BaCO
3②若所取蓝绿色固体质量为54.2g,实验结束后装置B的质量增加5.4g,C中的产生沉淀的质量为39.4g.则该蓝绿色固体的化学式为
.


 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为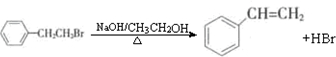
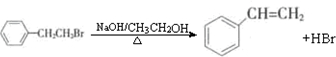


 (任写一种)
(任写一种) (任写一种)
(任写一种) 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有 I2+O2+H2O
I2+O2+H2O I2+O2+H2O
I2+O2+H2O


 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高