
题目列表(包括答案和解析)
(15分)二氧化硫是大气污染物之一,为粗略测定周围环境中二氧化硫的含量,某课外活动小组的甲、乙两位同学分别用相同实验装置和溶液,测定同一时间, 同一地点空气(含SO2、N2、O2气体,其他气体忽略)中SO2的含量。实验装置如右图反应试管中装有碘的淀粉稀溶液A。 SO2和I2发生反应为:S02+I2+2H20=H2SO4+2HI(N2、02不与I2、 淀粉反应),试回答下列问题:
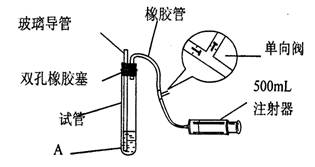
(1)检查该装置气密性时,先在试管中装入适量的水(保证玻璃管的下端浸在水中),然后_____________________(注意阀的单向性),则证明该装置的气密性良好。
(2)若A溶液的体积为VmL,浓度为c mol·L-1,当溶液的颜色刚好变色,停止抽气,此时甲、乙两位同学注射器内抽得气体的体积分别为V甲mL、V乙mL(所有的体积已折算成标况下体积),且V甲>V乙,则甲、乙两个测定结果中与该地点空气中S02的体积分数真实情况最接近的是_______________________(.用含c、V、V甲或V乙…等的关系式表示)。另一位实验结果产生较大误差的原因可能是_______________________________________________
(3)若将上述装置进行改进,除导管外,重新连接装置需要选用的仪器有___________________。 (选下列仪器的编号)
a、烧杯 b、试管 c、锥形瓶 d、容量瓶e、量筒 f、单孔塞 g.双孔塞
(4)欲净化空气,除去空气中的二氧化硫可选用的试剂是___________________。
(15分)某化学小组为测定加碘盐中KIO3的质是分数并制备少量KIO3,进行了如下实验。
I .测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知: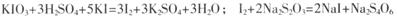
步骤一:准确称取a g加碘盐,配制成250 mL溶液;
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c mol.L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据。重复滴定2次,平均消耗Na2S2Or溶液12.00 mL。
(1) 步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有____________
(2) 步骤三中到达滴定终点时的现象为____________
(3) 实验测得此加碘盐中KIO3的质量分数="______" ______ (KIO3的相对分子质量为214)。
II.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到。
该化学小组通过以下装置制备KIO3
(4) 装置A中反应的离子方程式为____________
(5) 装置B中的试剂为____________
(6) 写出装置C中生成KIO3的离子方程式____________。
(7) 上述实验装置存在一处明显缺陷,请指出: __________________。
[化学—选修物质结构与性质] (15分)
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增。已知:
①Q为周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同; ③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为 ,其中心原子采取 杂化;化合物N的固态时的晶体类型为 。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为 。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为 (写分子式)。
(4)由R、X、Y三种元素所组成的RXY![]() 离子在酸性条件下可与NaClO反应,生成X2、RY2等物质。上述反应的离子方程式为 。
离子在酸性条件下可与NaClO反应,生成X2、RY2等物质。上述反应的离子方程式为 。
(5)Z原子基态时的外围电子排布式为 ,Z的一种含氧酸钡盐的晶胞结构如右图所示,晶体内与每个“Z”原子等距离且最近的氧原子数为 。
(15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g)H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l)H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
(每空3分,共15分)根据下框图关系,完成下列问题:
H(白色↓)不溶于盐酸,A、B都是酸式盐。
(1)工业生产D的典型设备是 ,工业生产F选择的条件是
(2)石墨电极电解C溶液时阳极的电极方程式是
(3)B溶液中加入I溶液反应恰好显中性时的离子方程式为
(4)B溶液与A溶液反应的离子方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com