
题目列表(包括答案和解析)
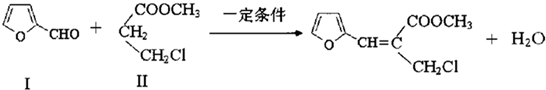

| 醇 |
| △ |
| 醇 |
| △ |
 )也能与化合物Ⅳ发生Knoevenagel反应,则其生成物的结构简式为
)也能与化合物Ⅳ发生Knoevenagel反应,则其生成物的结构简式为

 (任写一种)
(任写一种) (任写一种)
(任写一种)
 (2013?佛山一模)如图为元素周期表中短周期的一部分,下列说法不正确的是( )
(2013?佛山一模)如图为元素周期表中短周期的一部分,下列说法不正确的是( )(10分)为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签。某学生欲在实验室中配制500 mL该葡萄糖注射液。
| 葡萄糖注射液 |
| 规格:250mL(密度:1.08g·mL-1) 生产批号:1003203 2 有效期:至2013年10月 5% |
我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键??? b.氢键??? c.金属键??? d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中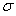 键与
键与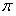 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
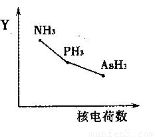
a.稳定性??????? b.沸点?????? c.R—H键能?????? d.分子间作用力
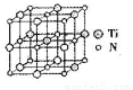
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com