(2013?芜湖模拟)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为
8mol
8mol
.
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
.
(3)单质B的燃烧热akJ/mol.由B、C二种元素组成的化合物BC14g完全燃烧放出bkJ热量,写出单质B和单质C反应生成BC的热化学方程式:
C(s)+
O
2(g)=CO(g);△H=-(a-2b)kJ/mol
C(s)+
O
2(g)=CO(g);△H=-(a-2b)kJ/mol
.
(4)工业上在高温的条件下,可以用A
2C和BC反应制取单质A
2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molA
2C和1molBC、2molA
2C和2molBC.一定条件下,充分反应后分别达到平衡(两容器温度相等).下列说法正确的是
AB
AB
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A
2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A
2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是
Al-3e-+4OH-=AlO2-+2H2O
Al-3e-+4OH-=AlO2-+2H2O
.

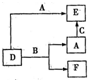 (2013?江西模拟)A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )
(2013?江西模拟)A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )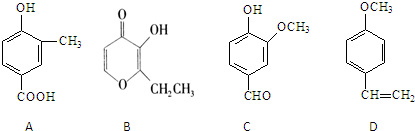
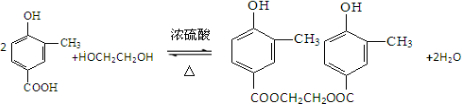

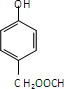

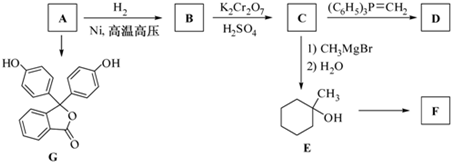
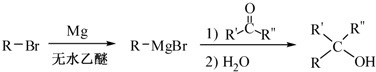
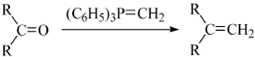

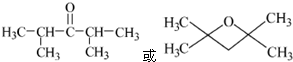
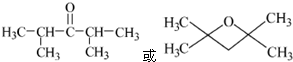
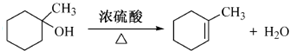

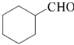 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2 (2013?绵阳模拟)A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大.其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的 简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体.
(2013?绵阳模拟)A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大.其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的 简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体.