
题目列表(包括答案和解析)
2(08浙江省开化中学模拟)实验室中根据2SO2+O2![]() 2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
 |
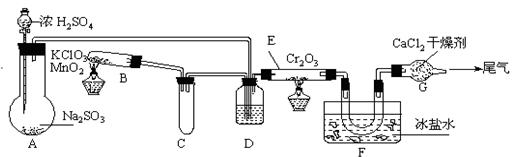
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是 。装置D的三个作用是 ①
② ③
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
(6)装置F中U型管内收集到的物质的颜色、状态是
(7)装置G的作用是
(8)从G装置导出的尾气处理方法是
(08浙江省开化中学模拟)实验室中根据2SO2+O2![]() 2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是 。装置D的三个作用是 ①
② ③
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
(6)装置F中U型管内收集到的物质的颜色、状态是
(7)装置G的作用是
(8)从G装置导出的尾气处理方法是
(08黄桥中学模拟)(12分)短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大。C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物。
(1)写出E的单质与A、D两元素形成其常见化合物反应的离子方程式.
(2)由A、C、D三元素所形成的常见盐溶液呈_________性(填“酸”、“中”、“碱”),其原因用离子方程式表示为:__________________________________________。
(3)B的相对分子质量最小的氢化物的燃烧热为890.3 kJ?mol-1,写出其燃烧的化学方程式________________________________________________________。
 (4)X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,某温度下相互转化时的量变关系如右图:
(4)X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,某温度下相互转化时的量变关系如右图:
(I)X的化学式是______________。
(Ⅱ)图中a、b、c、d四点中,表示反应处于平衡状态的是
______________。
(Ⅲ)该温度下,反应Y转化为X的平衡常数为 ______________。
(Ⅳ)反应进行到t2时刻,改变的条件可能是______________。
(08安徽萧县中学模拟)甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:

若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙。回答下列问题:
⑴乙的分子结构中一定含有的官能团是 (填名称);丙的分子结构中一定含有的官能团的电子式为 。
⑵乙、丙的相对分子质量之差为 (填一个数字)的整数倍。
⑶满足上述转化关系的甲、乙、丙、丁中,相对分子质量最小的甲的结构简式为 ,此时,生成丁的化学方程式为 。
(08黄桥中学模拟) 石油化工是江苏省的支柱产业之一。聚氯乙烯是用途十分广泛的石油化工产品,某化工厂曾利用下列工艺生产聚氯乙烯的单体氯乙烯:
CH2=CH2+Cl2→CH2CI―CH2C1…………………①
CH2Cl―CH2C1→CH2=CHCl+HCl………………②
请回答以下问题:
(1)已知反应①中二氯乙烷的产率)产率=![]() ×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8t乙烯可制得氯乙烯 t,同时得到副产物氯化氢 t。(计算结果保留1位小数)
×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8t乙烯可制得氯乙烯 t,同时得到副产物氯化氢 t。(计算结果保留1位小数)
(2)为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:
2CH2=CH2+4HCl+O2→2CH2Cl-CH2Cl+2H2O…………③
由反应①、③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供反应③使用,形成了新的工艺。
由于副反应的存在,生产中投入的乙烯全部被消耗时,反应①、③中二氯乙烷的产率依次为a%、c%;二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%。试计算:反应①、③中乙烯的投料比为多少时,新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中既不生成氯化氢,也不消耗氯化氢)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com