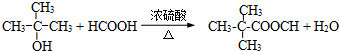
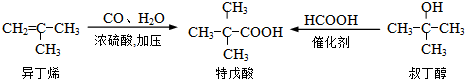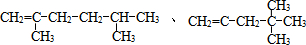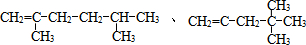(2013?浦东新区二模)工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS
2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe
1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe
2+又含有Fe
3+.
生产硫酸时将矿石煅烧,发生反应如下:
①4FeS
2+11O
2→2Fe
2O
3+8SO
2②4Fe
1-xS+(7-3x) O
2→2 (1-x) Fe
2O
3+4SO
2(1)含FeS
2 72%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸
12
12
吨(矿石中无其他含硫物质).
(2)若磁黄铁矿Fe
1-xS中x=0.1,则Fe
1-xS中Fe
2+与Fe
3+的物质的量之比为
3.5
3.5
:1.
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO
2,需通入过量20%的空气(其中N
2与O
2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO
2的体积分数(用含x的代数式表示).
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl
2 0.425mol,且溶液中无Fe
3+,计算Fe
1-xS中的x值(矿石中其他成分不与盐酸反应).