
(2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).
(1)若X为金属单质,W是某强酸的稀溶液.X与少量W反应生成Z的离子方程式为
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
,向Y溶液中加入某种试剂
硫氰化钾
硫氰化钾
(填试剂名称),若溶液出现血红色,即可判断Y溶液中阳离子的存在.
(2)若X、Y为正盐,X的水溶液显酸性,W为NaOH溶液,写出Y与X在水溶液中转化为Z的离子反应方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.
(3)若X为强碱,常温下W为有刺激性气味的气态氧化物.常温时,将Z的水溶液露置于空气中,溶液的PH变化是
变小
变小
(填“变大”、“变小”、“不变”.不考虑水的挥发),其原因是
亚硫酸根离子有还原性,易被空气中的氧气氧化生成硫酸根离子,2SO32-+O2=2SO42-,所以溶液的pH变小
亚硫酸根离子有还原性,易被空气中的氧气氧化生成硫酸根离子,2SO32-+O2=2SO42-,所以溶液的pH变小
(用简要的文字说明,并写出离子方程式)
(4)室温下,若用0.1mol/L的NaOH溶液滴定VmL0.1mol/L HA溶液,滴定曲线如2图所示,则a、b、c、d四点溶液中水的电离程度最大的是
c
c
点;a点溶液中离子浓度的大小顺序为
c(A-)>c(Na+)>c(H+)>c(OH-)
c(A-)>c(Na+)>c(H+)>c(OH-)
;取少量c点溶液于试管中,再滴加0.1mol/L盐酸至中性,此时溶液中除H
+、OH
-外,离子浓度的大小顺序为
c(Na+)>c(A-)>c(Cl-)
c(Na+)>c(A-)>c(Cl-)
.

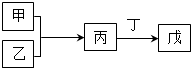 (2013?武汉模拟)甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
(2013?武汉模拟)甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( ) (2013?枣庄二模)C、N、O是中学化学常见的三种元素,请回答下列问题:
(2013?枣庄二模)C、N、O是中学化学常见的三种元素,请回答下列问题: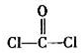 )分子中含有
)分子中含有 (2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).
(2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).