(2012?醴陵市模拟)实验室有一包暗红色粉末样品可能是CaCO
3、Fe
2O
3或FeO的混合物.后经测定已确定不存在FeO.
I.某学生想自己设计实验方案,以证明样品中确实没有FeO.除样品外,实验室只提供以下试剂:KMnO
4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液和双氧水.你认为要完成该实验所选择的试剂是
KMnO4溶液、稀硫酸
KMnO4溶液、稀硫酸
,请你描述实验操作时的步骤、实验现象和结论:
取少量样品溶于试管中,配成溶液后,再滴入几滴稀硫酸和几滴KMnO4溶液,只要溶液不褪色或不变浅,即说明样品中无FeO
取少量样品溶于试管中,配成溶液后,再滴入几滴稀硫酸和几滴KMnO4溶液,只要溶液不褪色或不变浅,即说明样品中无FeO
.
Ⅱ.测定混合物中Fe
2O
3的含量
实验室可用多种方法测出上述样品中Fe
2O
3的质量分数.现有学生准备用如图各装置按一定顺序连接成一套完整的组合装置来进行实验以测定Fe
2O
3的质量分数.
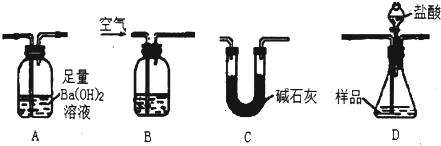
请根据题意回答下列问题:
(1)装置的连接顺序是
BDAC
BDAC
(填字母,每个装置只能用一次)
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还有一个重要作用是
将反应产生的CO2气体尽可能彻底的赶入装置A中,使之完全被Ba(OH)2溶液吸收
将反应产生的CO2气体尽可能彻底的赶入装置A中,使之完全被Ba(OH)2溶液吸收
(3)下列各项措施中,能提高测定准确度的是
ad
ad
(填标号)
a.在加入盐酸之前,应该排尽装置内的CO
2气体
b.快速加入盐酸
c.在B中装入浓硫酸
d.在B中装入NaOH溶液
e.D之后增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验室准确称取26.0g固体样品装入D中,充分反应后,测得A中沉淀质量为19.7g,则样品中Fe
2O
3的质量分数为
61.5%
61.5%
.
(5)在进行实验方案评价时,有学生认为不必测定A中的沉淀质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求.实验证明,若用此法测得Fe
2O
3的质量分数将
偏低
偏低
(填“偏高”、“偏低”、“不变”)

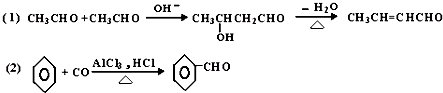

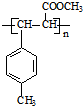

 (HOCH2)3CCHO
(HOCH2)3CCHO (HOCH2)3CCHO
(HOCH2)3CCHO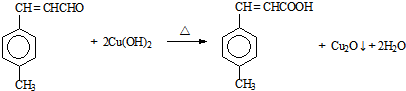


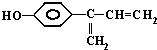

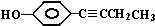

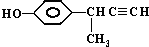


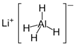 )、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
)、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )