
题目列表(包括答案和解析)
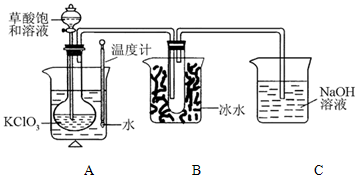

 Fe(OH)3+3H+,CaCO3+2H+=Ca2++H2O+CO2↑,促进Fe3+水解生成Fe(OH)3沉淀
Fe(OH)3+3H+,CaCO3+2H+=Ca2++H2O+CO2↑,促进Fe3+水解生成Fe(OH)3沉淀 Fe(OH)3+3H+,CaCO3+2H+=Ca2++H2O+CO2↑,促进Fe3+水解生成Fe(OH)3沉淀
Fe(OH)3+3H+,CaCO3+2H+=Ca2++H2O+CO2↑,促进Fe3+水解生成Fe(OH)3沉淀 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-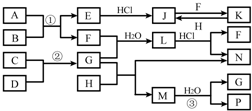
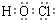
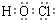
 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com