已知:在25时H
2O?H
++OH
-,K
W=10
-14;CH
3COOH?H
++CH
3COO
-,Ka=1.8×10
-5(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H
+)与C(CH
3COOH)的比值
减小
减小
(填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为
CH3COO-+H2O?CH3COOH+OH-;
CH3COO-+H2O?CH3COOH+OH-;
.当升高温度时,C(OH
-)将
增大
增大
(填“增大”“减小”“不变”);
(3)0.5mol?L
-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol?L
-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为
小于
小于
,a与b的关系为
大于
大于
(填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
.
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na
+)
小于
小于
c(CH
3COO
-)(填“大于”、“小于”或“等于”),
(6)若由pH=3的HA溶液V
1mL与pH=11的NaOH溶液V
2 mL.混合而得,则下列说法不正确的是
BC
BC
.
A.若反应后溶液呈中性,则c(H
+)+c(OH
-)=2×10
-7mol?L
-1B.若V
1=V
2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V
1一定大于V
2D.若反应后溶液呈碱性,则V
1一定小于V
2(7)在某溶液中含Mg
2+、Cd
2+、Zn
2+三种离子的浓度均为0.01mol?L
-1.向其中加入固体醋酸钠后测得溶液的C(OH
-)为2.2×10
-5mol?L
-1,(不考虑溶液体积变化)以上三种金属离子中
Cd2+、Zn2+
Cd2+、Zn2+
能生成沉淀,原因是
[OH-]=2.2×10-5mol?L-1 、[M2+][OH-]2=5×10-12(mol?L-1)3、5×10-12小于KSP[Mg(OH)2]=1.8×10-11 ,5×10-12大于KSP[Zn(OH)2]=1.2×10-17 ,5×10-12大于KSP[Cd(OH)2]=2.5×10-14.
[OH-]=2.2×10-5mol?L-1 、[M2+][OH-]2=5×10-12(mol?L-1)3、5×10-12小于KSP[Mg(OH)2]=1.8×10-11 ,5×10-12大于KSP[Zn(OH)2]=1.2×10-17 ,5×10-12大于KSP[Cd(OH)2]=2.5×10-14.
(K
SP[Mg(OH)
2]=1.8×10
-11、K
SP[Zn(OH)
2]=1.2×10
-17、K
SP[Cd(OH)
2]=2.5×10
-14)
(8)取10mL 0.5mol?L
-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H
+)=
1×10-12
1×10-12
.

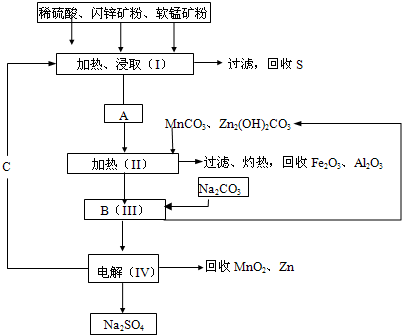


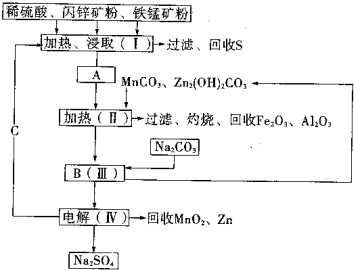 (2011?湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
(2011?湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下: