(2013?江苏)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca
3(PO
4)
2等形式存在.它的单质和化合物在工农业生产中有着重要的应用.
(1)白磷(P
4)可由Ca
3(PO
4)
2、焦炭和SiO
2 在一定条件下反应获得.相关热化学方程式如下:
2Ca
3(PO
4)2(s)+10C(s)═6CaO(s)+P
4(s)+10CO(g)△H
1=+3359.26kJ?mol
-1CaO(s)+SiO
2(s)═CaSiO
3(s)△H
2=-89.61kJ?mol
-12Ca
3(PO
4)
2(s)+6SiO
2(s)+10C(s)═6CaSiO
3(s)+P
4(s)+10CO(g)△H
3则△H
3=
+2821.6
+2821.6
kJ?mol
-1.
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P
4+60CuSO
4+96H
2O═20Cu3P+24H
3PO
4+60H
2SO
460molCuSO
4能氧化白磷的物质的量是
3mol
3mol
.
(3)磷的重要化合物NaH
2PO
4、Na
2HPO
4和Na
3PO
4可通过H
3PO
4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.

①为获得尽可能纯的NaH
2PO
4,pH应控制在
4~5.5(介于此区间内的任意值或区间均可)
4~5.5(介于此区间内的任意值或区间均可)
;pH=8时,溶液中主要含磷物种浓度大小关系为
c(HPO42-)>c(H2PO4-)
c(HPO42-)>c(H2PO4-)
.
②Na
2HPO
4溶液显碱性,若向溶液中加入足量的CaCl
2 溶液,溶液则显酸性,其原因是
3Ca2++2HPO42-═Ca3(PO4)2↓+2H+
3Ca2++2HPO42-═Ca3(PO4)2↓+2H+
(用离子方程式表示).
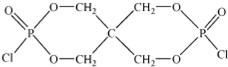
(4)磷的化合物三氯氧磷(
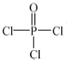
)与季戊四醇(
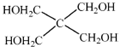
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.

①酸性气体是
HCl
HCl
(填化学式).
②X的结构简式为
.

 (2013?重庆)合金是建筑航空母舰的主体材料.
(2013?重庆)合金是建筑航空母舰的主体材料.


 )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.