
题目列表(包括答案和解析)
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。

图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
|
时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
|
温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论) 。
工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g)  CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。

请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
|
实验组 |
T/℃ |
起始浓度/mol•L-1 |
等质量催化剂的 比表面积/m2•g-1 |
|
|
CO |
H2 |
|||
|
① |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
② |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
|
③ |
350 |
|
|
124 |
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2 > p1)的曲线。
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。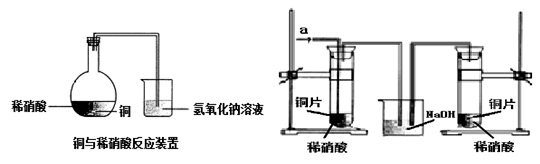
图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。

图 1 图 2
(1) 图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2) 小组同学提出了如下假设并设计实验探究:
Ⅰ. 甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ. 乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号),
A. 硝酸铜晶体 B. 硝酸铜溶液 C. 硫酸铜晶体 D. 硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论)
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com