
题目列表(包括答案和解析)
(17分)I.工业上有一种用CO2来生产甲醇燃料的方法:
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
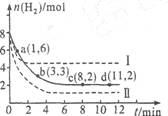
(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。其化学平衡常数K=
(2)下列时间段平均反应速率最大的是 ,
A.O~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 ,体积不变再充入3molCO2和4 mol H2,H2O(g)的体积分数 (填“增大”“不变”或“减小”)
Ⅱ.某实验小组欲探究 反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2S04溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、 、 ;
反应的方程式为
Ⅲ. 粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。
(1)电解结束后,在阳极附近的沉淀物中,主要的金属单质为 (填化学式)。
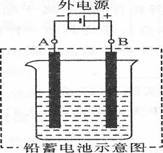
(2) 若按上图所示连接对铅蓄电池进行充电。充电一段时间后。则在A电极上生成 (填化学式)。B电极上的电极反应式为 ;充电完毕。铅蓄电池的正极是 极(填“A”或“B”)。
(3)如用甲烷燃料电池为电源,在25℃、101 kPa时,若CH4在氧气中直接燃烧生成1 mol水蒸气放热401 kJ,而l g水蒸气转化成液态水放热2.445 kJ,则CH4的燃烧热为 (取整数)kJ·mol-。
(17分)某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系(无机物略去):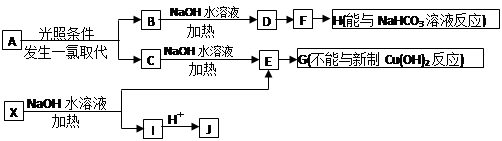
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为
(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为 、 ;
(3)E与H反应的化学方程式是
其反应类型是
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物K,以K为单体合成的高分子化合物的名称是
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。
(共17分) (1)下图是用KMnO4 与浓盐酸反应制取适量氯气的简易装置。
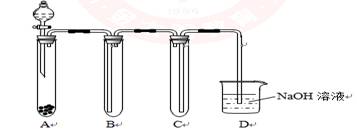
装置B、C、D的作用分别是:
B____________________C_________________ D
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是_________(填序号);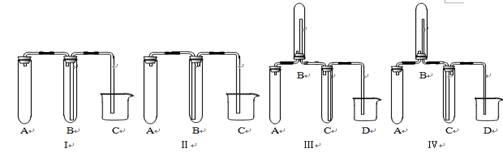
②根据所选的装置完成下表(不需要的可不填):
|
|
应加入的物质 |
所起的作用 |
|
A |
|
|
|
B |
|
|
|
C |
|
|
|
D |
|
|
③简单描述应观察到的实验现象:A中_______, , 。B中 。
(共17分)Ⅰ(11分)、一无色透明的溶液做如下实验:
ⅰ取少量溶液滴加盐 酸酸化的BaCl2溶液,只观察到有白色沉淀生成。
酸酸化的BaCl2溶液,只观察到有白色沉淀生成。
ⅱ另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成 沉淀的量的关系如图所示:
沉淀的量的关系如图所示: 试问:
试问:
(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、CO32-、K+、SO42-等离子中一定存在的离子是____、____、______;可能存在的离子是_______、_____;一定不存在的是______、____、_____、____。
(2)上述溶液至少由__________、_________等物质混合成。(填化学式)
Ⅱ(6分)、甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
(17分)实验室中有三瓶失去标签的酸,分别是浓硫酸、浓盐酸和浓硝酸。
(1)有同学认为,用金属铜做试剂可鉴别上述三种酸,请用化学方程式和必要的文字加以说明。____________________________________________________________________。
(2)请设计一个实验装置,使铜与稀硫酸反应生成硫酸铜与氢气。在下面的方框内画出装置图,并标明电极材料名称和电解质溶液名称。
(3) 实验室中欲用浓硫酸配制2.0mol·L-1的稀硫酸500mL。
①实验过程中所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有____________________;
②下列操作中造成所配溶液浓度偏低的是_____________。
a.用量筒量取浓硫酸时仰视刻度线
b.定容时俯视刻度线
c.转移溶液后未洗涤烧杯和玻璃棒就直接定容
d.定容后摇匀,发现液面低于刻度,未补加蒸馏水至刻度
(4)下图所示为实验室模拟工业上利用氨催化氧化法制备硝酸的实验
用装置A制备干燥氨气,装置B制备干燥氧气。
①装置A的试管中发生反应的化学方程式为_______________________________ 。
装置B的烧瓶内发生反应的化学方程式为__________________________________。
②下列关于A、B装置的叙述不正确的是__________
a.若选择合适的试剂,用B装置也可制备氨气
b.实验过程中,A、B装置中一定有一个发生氧化还原反应
c.U形管中的试剂可以相同,但作用不相同
③按照a接c,b接d的顺序连接装置进行实验。
玻璃管内发生反应的化学方程式为___________________________________。
实验结束后,某同学测得装置C中试管内所得溶液的pH<7,得出的结论为该溶液一定是硝酸。该结论__________(填“严密”或“不严密”),你的理由是_____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com