
题目列表(包括答案和解析)
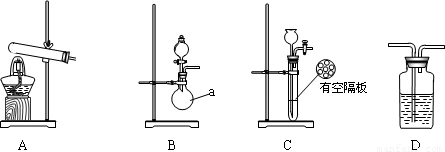
(共17分) (1)下图是用KMnO4 与浓盐酸反应制取适量氯气的简易装置。
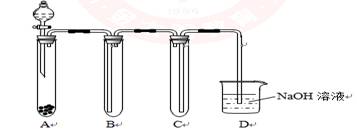
装置B、C、D的作用分别是:
B____________________C_________________ D
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是_________(填序号);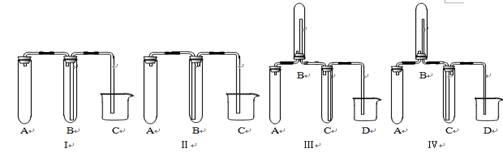
②根据所选的装置完成下表(不需要的可不填):
|
|
应加入的物质 |
所起的作用 |
|
A |
|
|
|
B |
|
|
|
C |
|
|
|
D |
|
|
③简单描述应观察到的实验现象:A中_______, , 。B中 。
(17分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
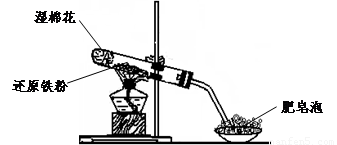
已知:①FeO + 2H+ = Fe2+ + H2O②Fe2O3 + 6H+ = 2Fe3+ +3 H2O ③Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4 H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为 。
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) ,若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) 。
A.一定有Fe3O4,可能有Fe B.只有Fe(OH)3 C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe E.只有Fe3O4
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 。
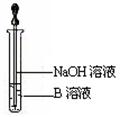
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 。
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是______________。反应开始时,打开止水夹的目的是___________________________________;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2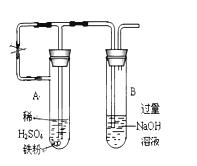
(17分)甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称 。
(2)检查A装置气密性的操作是 。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
|
|
实验装置 |
实验药品 |
制备原理 |
|
甲小组 |
A |
氢氧化钙、硫酸、硫酸铵 |
反应的化学方程式为 ① 。 |
|
乙小组 |
② |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③ 。 |
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为 。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是
。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是 。
(17分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。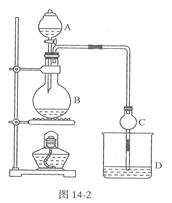
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
| A.五氧化二磷 | B.碱石灰 | C.无水硫酸钠 | D.生石灰 |
(17分) 现有下列十种物质:
①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2
⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
|
分类标准 |
金属单质 |
氧化物 |
溶液 |
胶体 |
电解质 |
|
属于该类的物质 |
|
|
|
|
|
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学方程式为__________________________________________________________。
(3)⑩在水中的电离方程式为__________________________________________________,
(4)少量的④通入⑥的溶液中反应的离子方程式为________________________________。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是____________(填化学式),氧化剂与还原剂的物质的量之比是_____________,当有5.4g Al发生反应时,转移电子的物质的量为_________________。该反应的离子方程式为___________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com