
题目列表(包括答案和解析)

| ||
| ||
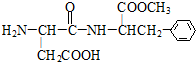 (2010?扬州模拟)如图是一种人工合成的甜味剂aspartame的结构简式,比一般的蔗糖甜160倍,由于它不会被消化而变为能量供给身体所需,所以适合一些减肥人士食用,目前是糖的最佳代用品.下列关于aspartame的描述正确的是( )
(2010?扬州模拟)如图是一种人工合成的甜味剂aspartame的结构简式,比一般的蔗糖甜160倍,由于它不会被消化而变为能量供给身体所需,所以适合一些减肥人士食用,目前是糖的最佳代用品.下列关于aspartame的描述正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com