
题目列表(包括答案和解析)
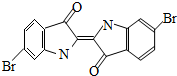 泰雅紫是古代地中海沿岸出产的一种贵重染料,罗马帝王用法律规定,只有皇族与教主可穿用这种染料染的紫色衣袍.当时人们是从小的紫蜗牛中提取泰雅紫的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如下图所示的含溴有机化合物,下列说法不正确的是 ( )
泰雅紫是古代地中海沿岸出产的一种贵重染料,罗马帝王用法律规定,只有皇族与教主可穿用这种染料染的紫色衣袍.当时人们是从小的紫蜗牛中提取泰雅紫的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如下图所示的含溴有机化合物,下列说法不正确的是 ( )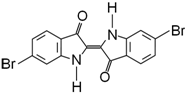 泰雅紫是一种贵重染料,其结构如图,下列说法中不正确的是( )
泰雅紫是一种贵重染料,其结构如图,下列说法中不正确的是( )下列说法不正确的是
A、 C2H4O可能的结构有3种
B、 烃分子中连有甲基,则氢原子不可能都在同一个平面上
C、 组成为CxH4的烃燃烧前后总体积不变
D、 甲苯既可发生加成反应,也可发生取代反应,还可发生氧化反应
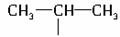 ?)相同,且同时符合下列两个条件的异构体的数目是… ( )?
?)相同,且同时符合下列两个条件的异构体的数目是… ( )? ①带有两个取代基的苯环 ②有一个硝基直接连在苯环上?
A.3 B.5 C.6 D.10
(15分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。2001年我国卫生部规定,饮用水中ClO2—的含量应不超过0.2mg·L-1。
饮用水中CIO2、CIO2—的含量可用连续碘量法进行测定。CIO2被I—还原为CIO2—、Cl—的转化率与溶液pH的关系如下图所示。当pH≤2.0时,CIO2—也能被I—完全还原成Cl—。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2==Na2S4O6+2NaI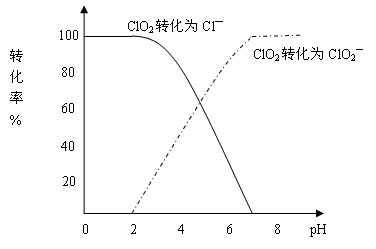
①请写出pH≤2.0时,CIO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的K I晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根⑤据你现有的知识,写出步骤4滴定至终点的现象判断依据为
④根据上述分析数据,测得该饮用水样中CIO2—的浓度为 mol·L-1(用含字母的代数式表示。)
⑤若饮用水中ClO2— 的含量超标,可向其中加入适量的Fe2+将ClO2— 还原成Cl—-, 请猜测该反应的氧化产物是 (填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com