
题目列表(包括答案和解析)
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性一定有:c(CH3COOH)= c(Cl-)
B.某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)= c(H+)+c(H2A)
C.常温下pH为2的盐酸,H2O电离出的c(H+)=1.0×10-2 mol·L-1
D.常温下,将50 mL0.l mol·L-1的盐酸与l00 mL0.1 mol·L-1的氨水混合,所得溶液中:
c(NH3·H2O)>c(Cl一)>c(NH4+)> c(OH-)>c(H+)
(1)写出HCO3—水解的离子方程式: ;
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3—、H2CO3、CO32—、 四种微粒的浓度由大到小的顺序为: 。
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
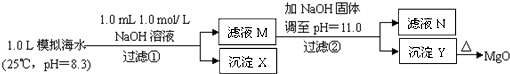 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com