
题目列表(包括答案和解析)
18.
(苏北三市14分) 如图甲所示,一边长L=2.5m、质量m=0.5kg的正方形金属线框,放在光滑绝缘的水平面上,整个装置放在方向竖直向上、磁感应强度B=0.8T的匀强磁场中,它的一边与磁场的边界MN重合。在水平力F作用下由静止开始向左运动,经过5s线框被拉出磁场。测得金属线框中的电流随时间变化的图像如乙图所示,在金属线框被拉出的过程中。
⑴求通过线框导线截面的电量及线框的电阻;
⑵写出水平力F随时间变化的表达式;
⑶已知在这5s内力F做功1.92J,那么在此过程中,线框产生的焦耳热是多少?
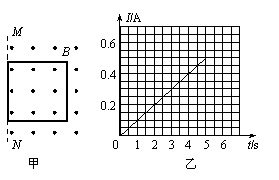 |


| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2.8cV |
| m1 |
| 2.8cV |
| m1 |

| ||
| ||
2- 4 |
2- 4 |
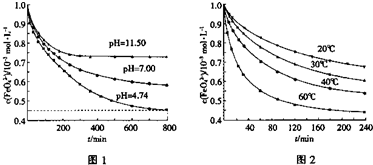
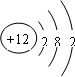
 (2013?枣庄二模)C、N、O是中学化学常见的三种元素,请回答下列问题:
(2013?枣庄二模)C、N、O是中学化学常见的三种元素,请回答下列问题: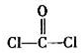 )分子中含有
)分子中含有湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com