
题目列表(包括答案和解析)
 (1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
(1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:| 3 |
| 2 |
| 3 |
| 2 |

| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | C-C | C-H | H-H | S-H | S-S | S-C |
| 键能/kJ.mol-1 | a | b | c | d | e | f |
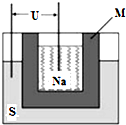 化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
| ||
(09江苏高考化学)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) , 某 I2、KI混合溶液中,
 I3-的物质的量浓度c(I3-)与温度T的关系如图所(曲线上任何一点都表示平衡状态)。下列说法正确的是:
I3-的物质的量浓度c(I3-)与温度T的关系如图所(曲线上任何一点都表示平衡状态)。下列说法正确的是:
A.反应I2(aq)+I-(aq)=I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com