
题目列表(包括答案和解析)
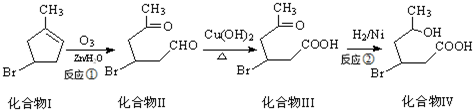

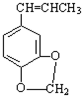 )发生类似反应1的反应,得到乙醛和化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为
)发生类似反应1的反应,得到乙醛和化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为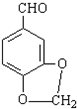


| 实验步骤 | 预期现象和结论 |
| 步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管I、II备用 | 溶液有颜色 溶液有颜色 |
| 步骤二:往试管I中, 滴加少量的淀粉KI溶液 滴加少量的淀粉KI溶液 |
若溶液变蓝色,则原溶液中含有Fe3+ 若溶液变蓝色,则原溶液中含有Fe3+ |
| 步骤三: 往试管II滴加到少量的KMnO4溶液 往试管II滴加到少量的KMnO4溶液 |
若溶液褪色(浅红),则原溶液中含有Fe2+,结合步骤二溶液变蓝,则假设3正确 若溶液褪色(浅红),则原溶液中含有Fe2+,结合步骤二溶液变蓝,则假设3正确 |
 (2012?茂名二模)以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
(2012?茂名二模)以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com