
题目列表(包括答案和解析)
下列混合物分离(或除杂)的方法正确的是( )
A.用CCl4可以从碘水中萃取碘
B.Fe(OH)3中含有少量Al(OH)3可加入适量的HCl除去
C.Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯
D.Fe(NO3)3中混有少量Fe(NO3)2的杂质可加入适量的氢氧化钠溶液除去
a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g ②(a+b)×189 g ③(a+b)mol ④(Vc- )mol
)mol
A.①④ B.②③ C.①③ D.②④
(9分)铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析下图,回答有关问题。
假设曲线的各段内只有一种还原产物,。
(1)0点到a点的还原产物是 。
(2)a点到b点的还原产物是__ __,其原因是 。
(3)试完成b点到c点的反应方程式:
口Fe+口HNO3——口Fe(NO3)3+口[ ]+口H20。
(4)反应过程中,到达 点时,HN03已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是 。
(6)c点和d点参加反应的铁的物质的量之比是 。
现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
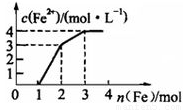
A.1∶1∶3 B.1∶2∶4 C.1∶1∶4 D. 1∶3∶1
化学方程式能够很直接形象的表示化学反应的过程与特征的一种符号,书写化学方程式是我们必须掌握一项基本技能。请按照要求完成下列方程式。
Ⅰ.生活中很多现象和原理都可以用化学反应来解释:写出 泡沫灭火器反应原理 的离子方程式:________________________________________________________________________
Ⅱ.某一反应体系有反应物和生成物共六种物质:N2O、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。写出该反应的化学方程式:______________________________________________
Ⅲ.有一些反应,表面上似乎违背了反应的基本原理,事实上他们是完全符合反应基本原理的。请完成下列反应:
① 写出 两种弱酸溶液混合反应后,溶液的酸性减弱 的化学方程式
________________________________________________________________________
② 写出 一种弱酸溶液与一种盐溶液混合发生复分解反应,生成强酸 的离子反应方程式
________________________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com